Hvilken har et højere kogepunkt HI eller HCl?
Kogepunktet for en forbindelse er den temperatur, hvor dens damptryk er lig med trykket omkring væsken, og væsken ændres til en damp. Kogepunktet for en forbindelse er påvirket af flere faktorer, herunder intermolekylære kræfter, molekylvægt og polaritet.
I tilfælde af HI og HCl er begge polære molekyler, men HI har stærkere intermolekylære kræfter end HCl på grund af jodatomets større størrelse. Jodatomets større størrelse resulterer i en større polariserbarhed af molekylet, hvilket fører til stærkere van der Waals-kræfter mellem HI-molekyler. Disse stærkere intermolekylære kræfter kræver mere energi at overvinde, for at væsken kan fordampe, hvilket resulterer i et højere kogepunkt for HI sammenlignet med HCl.
Derudover har HI en højere molekylvægt end HCl (127,9 g/mol vs. 36,46 g/mol), hvilket også bidrager til dets højere kogepunkt. De tungere molekyler af HI har mere inerti og kræver mere energi for at overvinde de intermolekylære kræfter og undslippe ind i dampfasen.
Derfor har HI et højere kogepunkt (424 K) sammenlignet med HCl (188 K) på grund af stærkere intermolekylære kræfter og højere molekylvægt.
Sidste artikelBetragtes H2O og O3 som molekyler?
Næste artikelKan en stærk elektrolyt være svag syre?
 Varme artikler
Varme artikler
-
 Kulbrændstoffer bliver grønne for vedvarende energiForskere ved Berkeley Lab og Joint Center for Artificial Photosynthesis har vist, at genanvendelse af kuldioxid til værdifulde kemikalier, såsom ethylen og propanol, og brændstoffer som ethanol, kan v
Kulbrændstoffer bliver grønne for vedvarende energiForskere ved Berkeley Lab og Joint Center for Artificial Photosynthesis har vist, at genanvendelse af kuldioxid til værdifulde kemikalier, såsom ethylen og propanol, og brændstoffer som ethanol, kan v -
 Hvordan grønne alger samler deres enzymerAnne Sawyer har fået ny indsigt i grønmaskernes proteinmaskineri. Kredit:RUB, Kramer Forskere ved Ruhr-Universität Bochum har analyseret, hvordan grønne alger fremstiller komplekse komponenter af
Hvordan grønne alger samler deres enzymerAnne Sawyer har fået ny indsigt i grønmaskernes proteinmaskineri. Kredit:RUB, Kramer Forskere ved Ruhr-Universität Bochum har analyseret, hvordan grønne alger fremstiller komplekse komponenter af -
 Hvad er forskellen mellem relativ luftfugtighed og dugpunkt?Kredit:The American Chemical Society Meteorologer rapporterer ofte mængden af fugt i luften som relativ fugtighed eller dugpunkt. Disse foranstaltninger kan være forvirrende for folk, der bare
Hvad er forskellen mellem relativ luftfugtighed og dugpunkt?Kredit:The American Chemical Society Meteorologer rapporterer ofte mængden af fugt i luften som relativ fugtighed eller dugpunkt. Disse foranstaltninger kan være forvirrende for folk, der bare -
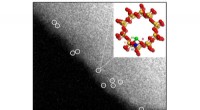 En måde at omdanne metan direkte til methanol eller eddikesyre under milde forholdAberrationskorrigerede HAADF/STEM-billeder af asyntetiseret Rh-ZSM-5. Enkelt rhodiumkationer er omkranset i hvidt med foreslået bold-stick-model af strukturen. Kredit:Lawrence F. Allard, medforfatter
En måde at omdanne metan direkte til methanol eller eddikesyre under milde forholdAberrationskorrigerede HAADF/STEM-billeder af asyntetiseret Rh-ZSM-5. Enkelt rhodiumkationer er omkranset i hvidt med foreslået bold-stick-model af strukturen. Kredit:Lawrence F. Allard, medforfatter
- Fra Alaska til Amazonia – første globale kort over egenskaber, der driver vegetationsvækst
- Fordelene ved at bombe en asteroide
- Materialet kan vende sollys, varme og bevægelse til elektricitet - alt på én gang
- Dugong og havskildpadde poo kaster nyt lys på Great Barrier Reefs havgræs enge
- Indiske astronomer opdager over 200 variable stjerner
- Hvor mange oxygenatomer er der i en formelenhed af natriumacetat?


