Eksempler på andre ublandbare væsker end olie?
1. Vand og olie :Ublandbarhed (manglende evne til at blande) er det mest kendte eksempel. Vand er polært (dets molekyler har forskellige positive og negative ender), mens olie er upolært (dets molekyler er mere symmetriske uden væsentlige ladningsforskelle).
2. Kviksølv og vand :Kviksølv (væske ved stuetemperatur) og vand er ublandbare. Kviksølvdråber i vandet forbliver distinkte og sfæriske på grund af deres sammenhængende natur og forskelle i tæthed.
3. Alkohol og olie :Mange alkoholer, såsom ethanol (drikker alkohol), er ikke blandbare med olier. Polaritetsforskellen mellem alkoholer og olier begrænser deres opløselighed i hinanden.
4. Eddike og olie :Eddike, som er en blanding af vand, eddikesyre og sporkomponenter, er ikke blandbar med olie. Vand- og eddikesyrekomponenterne kan kun delvist blandes med olie.
5. Glycerol og olie :Glycerol, også kendt som glycerin, er en tyk, tyktflydende væske. Det er ublandbart med olier på grund af deres forskellige polariteter og molekylære strukturer.
6. Vegetabilsk olie og sirup :Vegetabilske olier og sirup (f.eks. ahornsirup) er ikke-blandbare. Oliemolekylerne er hydrofobe og frastøder den vandbaserede sirup.
7. Benzen og vand :Benzen, et carbonhydridopløsningsmiddel, er ikke blandbart med vand. Benzenmolekyler er upolære og ikke-ioniske, mens vandmolekyler er polære og ioniske, hvilket fører til deres ublandbarhed.
8. Hexan og vand :I lighed med benzen er hexan (et andet carbonhydridopløsningsmiddel) ikke blandbart med vand. Begge væsker har vidt forskellige kemiske egenskaber.
9. Chloroform og vand :Chloroform, almindeligvis anvendt i organisk kemi, er ikke blandbar med vand. Det tilhører en klasse af væsker kaldet halogenerede kulbrinter, der har lav opløselighed i vand.
10. Carbontetrachlorid og vand :Carbontetrachlorid, når det først er blevet brugt som rensemiddel, er ikke blandbart med vand. Dens upolære molekylære struktur forhindrer den i at opløses i vand.
Sidste artikelHvad er Ph-niveauet for en stærk basisløsning?
Næste artikelHvad er ikke-ædle metaller?
 Varme artikler
Varme artikler
-
 Russiske videnskabsmænd udvikler teknologi til produktion af gennemsigtigt aluminiumKredit:National Research Nuclear University Specialister fra National Research Nuclear University MEPhI og multi-institutionelle samarbejdspartnere har udviklet en teknologi til at producere kompa
Russiske videnskabsmænd udvikler teknologi til produktion af gennemsigtigt aluminiumKredit:National Research Nuclear University Specialister fra National Research Nuclear University MEPhI og multi-institutionelle samarbejdspartnere har udviklet en teknologi til at producere kompa -
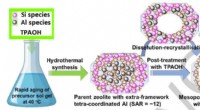 Forskere udvikler hul ZSM-5 zeolitkatalysator med lavt forhold mellem silicium og aluminiumSkematisk illustration af fremstillingen af de mesoporøse ZSM-5-P nanobokse via den hurtige ældning (af precursor sol-gelblandingen) og postsyntetisk TPAOH-behandling. Kredit:IMR ZSM-5 zeolit
Forskere udvikler hul ZSM-5 zeolitkatalysator med lavt forhold mellem silicium og aluminiumSkematisk illustration af fremstillingen af de mesoporøse ZSM-5-P nanobokse via den hurtige ældning (af precursor sol-gelblandingen) og postsyntetisk TPAOH-behandling. Kredit:IMR ZSM-5 zeolit -
 Forskere udvikler lagdelt koboltoxid med en rekordhøj termoelektrisk værdiBarium-koboltoxidfilmen (øverst til højre, ca. 1 cm2) udsættes for åben ild for at generere spænding. Kredit:Hiromichi Ohta Spildvarme er en meget lovende kilde til vedvarende energi; imidlertid,
Forskere udvikler lagdelt koboltoxid med en rekordhøj termoelektrisk værdiBarium-koboltoxidfilmen (øverst til højre, ca. 1 cm2) udsættes for åben ild for at generere spænding. Kredit:Hiromichi Ohta Spildvarme er en meget lovende kilde til vedvarende energi; imidlertid, -
 De fleste proteinoplysninger, der nogensinde er fanget fra en enkelt celle takket være ny nanoPOTS-…Chippen, der indeholder flere brønde, hvor proteiner fra enkelte celler adskilles til yderligere analyse. Kredit:PNNL Forskere har fået en række nøgleoplysninger om proteiner, alle cellers molekyl
De fleste proteinoplysninger, der nogensinde er fanget fra en enkelt celle takket være ny nanoPOTS-…Chippen, der indeholder flere brønde, hvor proteiner fra enkelte celler adskilles til yderligere analyse. Kredit:PNNL Forskere har fået en række nøgleoplysninger om proteiner, alle cellers molekyl
- Ny undersøgelse argumenterer for, at naboskabsforeninger bør afspejle de samfund, de tilhører
- Forskere præsenterer nye begrænsninger til direkte detektering af Sub-GeV mørkt stof
- Matematikere identificerer grænser for varmeflow på nanoskala
- Hvad vil der ske, når vores sol dør?
- Indiens ret til informationslov giver lektioner om regeringsgennemsigtighed
- Indonesias Lion Air køber 50 Boeing 737 for 6,2 mia. USD


