Hvilke elektroner er atomets valance?
Antallet af valenselektroner et atom har afhænger af dets atomnummer. For eksempel har brint en valenselektron, helium har to, og lithium har tre. Antallet af valenselektroner bestemmer atomets plads i det periodiske system og dets kemiske gruppe.
Valenselektroner er vigtige for at bestemme et atoms kemiske egenskaber, fordi de er de elektroner, der deltager i kemiske reaktioner. De er også ansvarlige for atomets evne til at danne bindinger med andre atomer. Arrangementet af valenselektronerne i et atoms ydre skal bestemmer dets kemiske egenskaber.
For eksempel er atomer med en fuld ydre skal af elektroner stabile og ikke-reaktive, mens atomer med en ufuldstændig ydre skal er reaktive og nemt kan danne bindinger med andre atomer. Antallet af valenselektroner, et atom har, påvirker også dets evne til at lede elektricitet. Atomer med en fuld ydre skal af elektroner er dårlige ledere af elektricitet, mens atomer med en ufuldstændig ydre skal er gode ledere af elektricitet.
 Varme artikler
Varme artikler
-
 Forskere opdager naturligt plantebaseret fødevarekonserveringsmiddelForskere ved NTU Singapore har opdaget et plantebaseret fødevarekonserveringsmiddel, der er mere effektivt end kunstige konserveringsmidler. Kredit:NTU Singapore Nanyang Teknologisk Universitet, S
Forskere opdager naturligt plantebaseret fødevarekonserveringsmiddelForskere ved NTU Singapore har opdaget et plantebaseret fødevarekonserveringsmiddel, der er mere effektivt end kunstige konserveringsmidler. Kredit:NTU Singapore Nanyang Teknologisk Universitet, S -
 Den amerikanske gigant Monsanto kendt for kontroversielle kemikalierDet Internationale Agentur for Kræftforskning, en del af FNs Verdenssundhedsorganisation, klassificerede i 2015 Roundups hovedingrediens glyphosat som et sandsynligt kræftfremkaldende stof Fra Age
Den amerikanske gigant Monsanto kendt for kontroversielle kemikalierDet Internationale Agentur for Kræftforskning, en del af FNs Verdenssundhedsorganisation, klassificerede i 2015 Roundups hovedingrediens glyphosat som et sandsynligt kræftfremkaldende stof Fra Age -
 Grafenmembraner kan gøre atomindustrien grønnereKredit:University of Manchester Grafen kunne hjælpe med at reducere energiomkostningerne ved at producere tungt vand og dekontaminering i atomkraftværker med over hundrede gange sammenlignet med n
Grafenmembraner kan gøre atomindustrien grønnereKredit:University of Manchester Grafen kunne hjælpe med at reducere energiomkostningerne ved at producere tungt vand og dekontaminering i atomkraftværker med over hundrede gange sammenlignet med n -
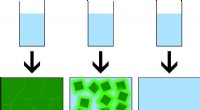 Mysteriet om amorf perovskit løstIllustrationen viser, at jo mere methylammoniumacetat (MAAc) vi tilsætter, jo mindre orden ser vi i vores materiale. Dette spænder fra fuldt krystallinsk, i grøn, til amorf med krystallinsk, meget lys
Mysteriet om amorf perovskit løstIllustrationen viser, at jo mere methylammoniumacetat (MAAc) vi tilsætter, jo mindre orden ser vi i vores materiale. Dette spænder fra fuldt krystallinsk, i grøn, til amorf med krystallinsk, meget lys
- Hvordan starter de jetmotorer på fly?
- Giftige biprodukter fra Agent Orange fortsætter med at forurene miljøet i Vietnam, siger undersøg…
- Billede:CST-100 Starliner-fremstilling
- Carbon nanorør udviklet til super effektiv afsaltning
- Lys, hvordan mikroskoper fungerer
- Polariserende, opsigtsvækkende mediedækning af transkønnede atleter bør ophøre. Vores forskning…


