Er natriumhydrogencarbonat en svagere base end carbonat?
Forstå det grundlæggende:
Basiciteten eller styrken af en base afhænger af dens evne til at donere hydroxidioner (OH-) i en vandig opløsning. Jo flere hydroxidioner en base kan frigive, jo stærkere er den.
Sammenligning af natriumhydrogenkarbonat og karbonat:
1. Dissociation:
Natriumhydrogencarbonat gennemgår delvis dissociation i vand, hvorved der frigives en hydrogenion (H+) og en bicarbonation (HCO3-).
NaHCO3(s) ⇌ Na^+(aq) + HCO3^-(aq)
Bicarbonationen har en basisk natur på grund af dens evne til at acceptere H+ ioner og danne kulsyre (H2CO3), som efterfølgende dissocierer i H+ og HCO3- ioner.
HCO3^-(aq) + H2O(l) ⇌ H2CO3(aq) + OH^-(aq)
2. Ligevægt:
Ligevægten mellem dannelsen af H2CO3 og OH-ioner forskydes mod dannelsen af H2CO3, hvilket indikerer, at natriumhydrogencarbonat er en svagere base. Ligevægtskonstanten (Kb) for denne reaktion er relativt lav, hvilket indikerer en lavere tendens til at frigive OH-ioner.
3. pH:
Vandige opløsninger af natriumhydrogencarbonat har en let basisk pH, typisk omkring 8,3. Dette skyldes den begrænsede koncentration af hydroxidioner, der frigives ved delvis dissociation af HCO3-ioner. I modsætning hertil undergår carbonatsalte, såsom natriumcarbonat (Na2CO3), fuldstændig dissociation, hvilket frigiver to hydroxidioner for hver carbonation, hvilket resulterer i en højere pH og stærkere basicitet.
Derfor danner natriumhydrogencarbonat, som er en svagere syre, en stærkere konjugeret base (bicarbonation) sammenlignet med carbonat. Som et resultat er natriumhydrogencarbonat en svagere base end carbonat.
 Varme artikler
Varme artikler
-
 Forskere løser strukturen af intellektuelt handicap proteinKredit:University of Dundee Forskere ved University of Dundee har identificeret virkningerne af en mutation, der giver anledning til en form for intellektuel handicap. intellektuel funktionsnedsæ
Forskere løser strukturen af intellektuelt handicap proteinKredit:University of Dundee Forskere ved University of Dundee har identificeret virkningerne af en mutation, der giver anledning til en form for intellektuel handicap. intellektuel funktionsnedsæ -
 Skaler til nye højder med gekko-inspireret klæbemiddelKredit:American Chemical Society Nogle dyr, såsom gekkoer, kan nemt klatre op ad vægge og på tværs af lofter. Men pt. Der findes ikke noget materiale, der gør det muligt for almindelige mennesker
Skaler til nye højder med gekko-inspireret klæbemiddelKredit:American Chemical Society Nogle dyr, såsom gekkoer, kan nemt klatre op ad vægge og på tværs af lofter. Men pt. Der findes ikke noget materiale, der gør det muligt for almindelige mennesker -
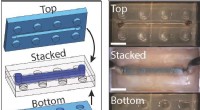 Dynamisk hydrogel bruges til at lave bløde robotkomponenter og LEGO-lignende byggeklodserLEGO-lignende hydrogel byggeklodser mønstret med bittesmå væskekanaler kan samles til komplekse mikrofluidiske enheder og derefter forsegles tæt sammen. Kredit:Wong Lab / Brown University Ved at b
Dynamisk hydrogel bruges til at lave bløde robotkomponenter og LEGO-lignende byggeklodserLEGO-lignende hydrogel byggeklodser mønstret med bittesmå væskekanaler kan samles til komplekse mikrofluidiske enheder og derefter forsegles tæt sammen. Kredit:Wong Lab / Brown University Ved at b -
 Frysrammemikroskopi indfanger molekyler, der låses og belastes af DNATranskriptionsfaktor IID -komplekset låser sig på DNA, kontrollerer, at det er det rigtige sted og rekrutterer derefter andre proteiner til at begynde at transkribere DNA til RNA. Nye fremskridt inden
Frysrammemikroskopi indfanger molekyler, der låses og belastes af DNATranskriptionsfaktor IID -komplekset låser sig på DNA, kontrollerer, at det er det rigtige sted og rekrutterer derefter andre proteiner til at begynde at transkribere DNA til RNA. Nye fremskridt inden
- Forskere rapporterer nyt, mere effektiv katalysator til vandspaltning
- Udforsker, hvordan vores sociale interaktioner begynder i en ung alder
- Vortex-antivortex-par findes i magnetiske trilag
- Hvorfor foretrækkes silicium frem for germanium?
- Facebook for at advare brugere, der kunne lide coronavirus-hoax
- Hvordan eutrofiering og klimaændringer ændrer fødenettet i Østersøen


