Ifølge VSPER teori vil de ydre atomer i et simpelt molekyle være arrangeret således, at?
Generelt vil elektronparrene antage en konfiguration, der maksimerer afstanden mellem dem, hvilket resulterer i den mest stabile molekylære struktur. For eksempel, i et molekyle med fire elektronpar, er den tetraedriske geometri det mest stabile arrangement, hvor de fire elektronpar er placeret i hjørnerne af et tetraeder og peger væk fra hinanden. I et molekyle med tre elektronpar er den trigonale plane geometri den mest stabile, med de tre elektronpar placeret i hjørnerne af en ligesidet trekant, hvilket igen maksimerer afstanden mellem elektronparrene.
VSEPR teorien giver os mulighed for at forudsige den molekylære geometri og form af simple molekyler ved at overveje antallet og typen af elektronpar omkring det centrale atom og bestemme arrangementet, der minimerer elektronpar frastødning.
 Varme artikler
Varme artikler
-
 Verifikation af whisky ved hjælp af laserlysKredit:CC0 Public Domain Forskere fra University of St Andrews har udviklet en innovativ ny teknik ved hjælp af lasere til nøjagtigt at måle ægtheden af nogle af verdens mest eksklusive whiskyer
Verifikation af whisky ved hjælp af laserlysKredit:CC0 Public Domain Forskere fra University of St Andrews har udviklet en innovativ ny teknik ved hjælp af lasere til nøjagtigt at måle ægtheden af nogle af verdens mest eksklusive whiskyer -
 3-D printede dæk og sko, der reparerer sig selvAfskåret 3D-printet skopude reparerer sig selv. Kredit:An Xin og Kunhao Yu I stedet for at smide dine ødelagte støvler eller revnet legetøj væk, hvorfor ikke lade dem ordne sig selv? Forskere ved
3-D printede dæk og sko, der reparerer sig selvAfskåret 3D-printet skopude reparerer sig selv. Kredit:An Xin og Kunhao Yu I stedet for at smide dine ødelagte støvler eller revnet legetøj væk, hvorfor ikke lade dem ordne sig selv? Forskere ved -
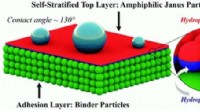 Forskning viser potentiale til at forbedre maling, belægningerKredit: Materialer Horisonter (2020). DOI:10.1039/D0MH00589D Ny forskning fra Binghamton University, State University of New York kan føre til mere miljøvenlige malinger og belægninger. I romers
Forskning viser potentiale til at forbedre maling, belægningerKredit: Materialer Horisonter (2020). DOI:10.1039/D0MH00589D Ny forskning fra Binghamton University, State University of New York kan føre til mere miljøvenlige malinger og belægninger. I romers -
 Fremstilling af lettere køretøjer med magnesiumlegeringerBarber kun 100 kg af en bils vægt, og du vil øge dens energieffektivitet med omkring 3,5 %. Kredit:iStock EPFL-forskere har udviklet modeller af magnesiumlegeringer for at forstå, hvordan man gør
Fremstilling af lettere køretøjer med magnesiumlegeringerBarber kun 100 kg af en bils vægt, og du vil øge dens energieffektivitet med omkring 3,5 %. Kredit:iStock EPFL-forskere har udviklet modeller af magnesiumlegeringer for at forstå, hvordan man gør


