Hvad er ligningen for at omdanne ammoniak til salpetersyre?
$$4NH_3(g) + 5O_2(g) → 4NO(g) + 6H_2O(g)$$
$$ 2NO(g) + O_2(g) → 2NO_2(g)$$
$$3NO_2(g) + H_2O(l) → 2HNO_3(aq) + NO(g)$$
Den overordnede reaktion er:
$$4NH_3(g) + 6O_2(g) → 4HNO_3(aq) + 2H_2O(g)$$
Denne proces udføres i tre trin:
1. Ammoniakoxidation: I dette trin oxideres ammoniak ($NH_3$) til nitrogenoxid ($NO$) og vanddamp ($H_2O$) i nærværelse af en platin-rhodium-gazekatalysator ved en temperatur på ca. 850°C.
2. Nitrogendioxidoxidation: I det andet trin oxideres nitrogenoxid ($NO$) yderligere til nitrogendioxid ($NO_2$) i nærværelse af oxygen ($O_2$) ved en lavere temperatur på omkring 200°C.
3. Absorption af salpetersyre: I det sidste trin absorberes nitrogendioxid ($NO_2$) i vand for at danne salpetersyre ($HNO_3$) og nitrogenoxid ($NO$), som recirkuleres tilbage til det andet trin.
Sidste artikelEr flydende ilt det samme som almindelig ilt?
Næste artikelHvordan blev wolfram opdaget?
 Varme artikler
Varme artikler
-
 Cyborg-teknologi kunne muliggøre ny diagnostik, fusion af mennesker og AIMolekylær model af PEDOT med maleimid; kulstofatomer er grå, oxygen røde, nitrogen blå, svovler gule og hydrogener hvide. Kredit:David Martin Selvom sande cyborgs - delvist er menneskelige, delvis
Cyborg-teknologi kunne muliggøre ny diagnostik, fusion af mennesker og AIMolekylær model af PEDOT med maleimid; kulstofatomer er grå, oxygen røde, nitrogen blå, svovler gule og hydrogener hvide. Kredit:David Martin Selvom sande cyborgs - delvist er menneskelige, delvis -
 Sous vide tilberedningsmetode gør oksekødsprotein mere fordøjeligtKredit:American Chemical Society Engang brugt til at tilberede køkken på kun de fineste restauranter, sous vide er nu på vej ind i hjemmekokernes køkkener. Fransk for under vakuum, Teknikken indeb
Sous vide tilberedningsmetode gør oksekødsprotein mere fordøjeligtKredit:American Chemical Society Engang brugt til at tilberede køkken på kun de fineste restauranter, sous vide er nu på vej ind i hjemmekokernes køkkener. Fransk for under vakuum, Teknikken indeb -
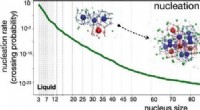 Hastighedsforudsigelse for homogen kernedannelse af methanhydratKredit:HIMS Metanhydrater er den største enkeltkilde til fossilt brændstof på planeten jorden og spiller en rolle i klimaændringer. Den molekylære proces af deres dannelse er ikke kendt og stærkt
Hastighedsforudsigelse for homogen kernedannelse af methanhydratKredit:HIMS Metanhydrater er den største enkeltkilde til fossilt brændstof på planeten jorden og spiller en rolle i klimaændringer. Den molekylære proces af deres dannelse er ikke kendt og stærkt -
 Smuk som en påfugl:Ædelstenen til næste generation af smarte sensorerKredit:CC0 Public Domain Forskere har hentet inspiration fra biomimik af sommerfuglevinger og påfuglefjer for at udvikle et innovativt opallignende materiale, der kunne være hjørnestenen i næste g
Smuk som en påfugl:Ædelstenen til næste generation af smarte sensorerKredit:CC0 Public Domain Forskere har hentet inspiration fra biomimik af sommerfuglevinger og påfuglefjer for at udvikle et innovativt opallignende materiale, der kunne være hjørnestenen i næste g
- Hvilken del af et atom spiller en stor rolle i kemiske reaktioner?
- Den overraskende grund til, at nogle lemurer kan være mere følsomme over for tab af skov
- Ideel metode til hurtig sygdomstestning
- Sådan fungerer solar madlavning
- Hvordan Stillehavets tiårsoscillation modulerer den El Niño-relaterede transportanomali mod øst
- Det tager en DJ:Sunde revlyde kan lokke fisk til beskadigede rev


