Hvad er koncentrationen af en HBr-opløsning i 12,0 mL neutraliseret af 15,0 0,25 M KOH-opløsning?
$$M_1V_1 =M_2V_2$$
Hvor:
M1 =Koncentration af HBr-opløsning (ukendt)
V1 =Volumen af HBr-opløsning (12,0 ml)
M2 =Koncentration af KOH-opløsning (0,25 M)
V2 =Volumen af KOH-opløsning (15,0 ml)
Ved at erstatte værdierne i formlen får vi:
$$M_1 \times 12,0 \texttt{ mL} =0,25 \texttt{ M} \times 15,0 \texttt{ mL}$$
Ved at løse for M1 får vi:
$$M_1 =\frac{0.25 \texttt{ M} \times 15.0 \texttt{ mL}}{12.0 \texttt{ mL}}$$
$$M_1 =0,3125 \texttt{ M}$$
Derfor er koncentrationen af HBr-opløsningen 0,3125 M.
Sidste artikelHvad er ligningen for neutralisering af saltsyre og phenolphtalein?
Næste artikelHvilken farve er kviksølvklorid?
 Varme artikler
Varme artikler
-
 Koffein sænker bevægelsen af vandmolekylerKoffein får et vandmolekyle (H2O) til at falde i søvn. Kredit:I. Cerjak (AMOLF) I modsætning til den velkendte stimulerende effekt på mennesker, koffein bremser bevægelsen af vandmolekyler. Det
Koffein sænker bevægelsen af vandmolekylerKoffein får et vandmolekyle (H2O) til at falde i søvn. Kredit:I. Cerjak (AMOLF) I modsætning til den velkendte stimulerende effekt på mennesker, koffein bremser bevægelsen af vandmolekyler. Det -
 At finde årsagen til kapacitetstab i et metaloxid-batterimaterialeSooyeon Hwang (siddende), Dong Su (venstre, stående, og Shuang Li ved Brookhaven Labs Center for Functional Nanomaterials, hvor de brugte elektronmikroskoper til at se, hvordan krystalstrukturen og de
At finde årsagen til kapacitetstab i et metaloxid-batterimaterialeSooyeon Hwang (siddende), Dong Su (venstre, stående, og Shuang Li ved Brookhaven Labs Center for Functional Nanomaterials, hvor de brugte elektronmikroskoper til at se, hvordan krystalstrukturen og de -
 Forskere skaber en ny type intelligent materialeTeamet, der skabte 2D-elektrolytterne, blev ledet af prof. Antonio Castro Neto (til højre), Direktør for CA2DM. Med ham er fru Mariana Costa (til venstre), publikationens første forfatter. Kredit:Nati
Forskere skaber en ny type intelligent materialeTeamet, der skabte 2D-elektrolytterne, blev ledet af prof. Antonio Castro Neto (til højre), Direktør for CA2DM. Med ham er fru Mariana Costa (til venstre), publikationens første forfatter. Kredit:Nati -
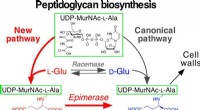 Ny biosyntetisk vej unik for patogene mikroorganismerDen nyligt opdagede vej involverer to gener, som letter bindingen af L-Glu til UDP-MurNAc-L-Ala og derefter epimeriserer (isomeriserer) L-Glu til D-Glu. Kredit:Dairi T. et al., Journal of the Americ
Ny biosyntetisk vej unik for patogene mikroorganismerDen nyligt opdagede vej involverer to gener, som letter bindingen af L-Glu til UDP-MurNAc-L-Ala og derefter epimeriserer (isomeriserer) L-Glu til D-Glu. Kredit:Dairi T. et al., Journal of the Americ
- Hvorfor den rigtige King Kong uddøde
- Robotter vs. mennesker:Hvilken stoler børn mest på, når de lærer ny information?
- Hvad får dette invasive, ikke-hjemmehørende rørgræs til at trives i vådområderne?
- Fare for åndedrætsolie Smoke
- Sådan viser du en VFD på en Schematic
- Asiatiske elefanter har en nasal udtale


