Hvad er forskellen mellem ioniske krystaller og metallisk binding?
Ioniske krystaller dannes, når elektroner overføres fra et atom til et andet, hvilket skaber positivt og negativt ladede ioner. Disse ioner tiltrækkes derefter af hinanden af de modsatte ladninger og danner en stabil krystalstruktur. Ioniske krystaller er typisk hårde, sprøde og har høje smeltepunkter. De er også gode elektriske ledere, når de er opløst i vand eller smeltet. Nogle eksempler på ioniske krystaller omfatter natriumchlorid (NaCl), kaliumiodid (KI) og calciumfluorid (CaF2).
Metallisk binding på den anden side dannes, når metalatomernes yderste elektroner delokaliseres, hvilket betyder, at de ikke er forbundet med noget bestemt atom. Disse delokaliserede elektroner danner et "hav" af elektroner, der omgiver de positive metalioner, og holder dem sammen i en stabil struktur. Metalliske bindinger er typisk stærke, duktile og har høj elektrisk og termisk ledningsevne. Nogle eksempler på metaller omfatter kobber (Cu), aluminium (Al) og jern (Fe).
Her er en tabel, der opsummerer de vigtigste forskelle mellem ioniske krystaller og metallisk binding:
| Ejendom | Ioniske krystaller | Metallisk limning |
|---|---|---|
| Obligationstype | Overførsel af elektroner | Delokalisering af elektroner |
| Struktur | Positivt og negativt ladede ioner | Positive metalioner omgivet af et hav af elektroner |
| Hårdhed | Hård og skør | Blød og formbar |
| Smeltepunkt | Høj | Lav |
| Elektrisk ledningsevne | God, når den er opløst i vand eller smeltet | Godt |
| Termisk ledningsevne | Dårlig | Godt |
Samlet set er ionkrystaller og metallisk binding to forskellige typer kemiske bindinger med forskellige egenskaber og karakteristika.
 Varme artikler
Varme artikler
-
 Hurtig urintest for amfetamin sender resultater via appDenne figur repræsenterer den nyudviklede amfetaminsensor med et trådløst kommunikationssystem. Lægemiddelsensoren består af en meget følsom organisk transistorplatform funktionaliseret med lægemiddel
Hurtig urintest for amfetamin sender resultater via appDenne figur repræsenterer den nyudviklede amfetaminsensor med et trådløst kommunikationssystem. Lægemiddelsensoren består af en meget følsom organisk transistorplatform funktionaliseret med lægemiddel -
 Forskning kan dramatisk sænke omkostningerne ved elektronkilderKunstnerens repræsentation af en halogenid perovskit fotokatode. Forskere ved Rice University og Los Alamos National Laboratory fandt, at halogenid-perovskit-halvledere (sølv) behandlet med et tyndt l
Forskning kan dramatisk sænke omkostningerne ved elektronkilderKunstnerens repræsentation af en halogenid perovskit fotokatode. Forskere ved Rice University og Los Alamos National Laboratory fandt, at halogenid-perovskit-halvledere (sølv) behandlet med et tyndt l -
 Næste generations medicin:Hvor kemi møder beregningEn kunstners skildring af den programmerbare divergerende synteseproces. Kredit:Hiroki Oguri, TUAT En gruppe japanske forskere hovedsageligt fra Tokyo University of Agriculture and Technology (TUA
Næste generations medicin:Hvor kemi møder beregningEn kunstners skildring af den programmerbare divergerende synteseproces. Kredit:Hiroki Oguri, TUAT En gruppe japanske forskere hovedsageligt fra Tokyo University of Agriculture and Technology (TUA -
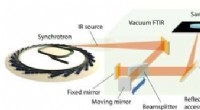 Undersøgelse af de komplekse dielektriske egenskaber af metal-organiske rammer (MOF'er)Figur 1:Den eksperimentelle opsætning til måling af bredbånds-IR-reflektiviteten af polykrystallinske MOF-pellets. De opnåede højopløsningsreflektivitetsdata blev efterfølgende brugt til at bestemme
Undersøgelse af de komplekse dielektriske egenskaber af metal-organiske rammer (MOF'er)Figur 1:Den eksperimentelle opsætning til måling af bredbånds-IR-reflektiviteten af polykrystallinske MOF-pellets. De opnåede højopløsningsreflektivitetsdata blev efterfølgende brugt til at bestemme
- Cellelignende nanorobotter fjerner bakterier og toksiner fra blod
- Ny måde at genbruge plantebaseret plast i stedet for at lade dem rådne på losseplads
- Eksempler på adsorption
- Hvorfor det kan være en god idé at udskyde matematik
- Fortalere bebrejder Facebook for vildledende opslag fra politikere
- Undersøgelse viser, at digitale medier har en skadelig indvirkning på reintegration af hvidkravekr…


