Hvordan kan man få en kemisk reaktion til at gå hurtigere?
1. Temperatur :Forøgelse af temperaturen af en reaktion øger generelt reaktionshastigheden. Højere temperaturer giver mere energi til de reagerende molekyler, hvilket giver dem mulighed for at overvinde aktiveringsenergibarrieren og reagere hurtigere. Dette princip er kendt som Arrhenius-ligningen. Vær dog opmærksom på, at ekstremt høje temperaturer kan denaturere enzymer eller nedbryde reaktanter i visse reaktioner.
2. Koncentration :Forøgelse af koncentrationen af reaktanterne øger sandsynligheden for kollisioner mellem dem, hvilket fører til en højere frekvens af vellykkede reaktioner. Med en højere koncentration er der flere reaktantpartikler tilgængelige til at deltage i reaktionen.
3. Overfladeareal :Forøgelse af overfladearealet af faste reaktanter øger antallet af eksponerede partikler, der er tilgængelige for reaktion. For eksempel øger slibning af et fast stof til et pulver dets overfladeareal og øger reaktionshastigheden.
4. Katalysatorer :En katalysator er et stof, der øger hastigheden af en kemisk reaktion uden at blive forbrugt i reaktionen. Katalysatorer giver en alternativ reaktionsvej med en lavere aktiveringsenergi, hvilket tillader reaktionen at forekomme hurtigere ved lavere temperaturer og koncentrationer. Enzymer er biologiske katalysatorer, der spiller en afgørende rolle i at lette biokemiske reaktioner i levende organismer.
5. Lys :I fotokemiske reaktioner absorberes lysenergi af reaktanter, hvilket fremmer dem til en exciteret tilstand med højere energi. Dette kan igangsætte eller fremskynde kemiske reaktioner. Fotosyntese i planter er et velkendt eksempel på en lysafhængig reaktion.
6. Tryk :Stigende tryk kan øge reaktionshastigheden, hvis mindst en af reaktanterne er en gas. Højere tryk øger koncentrationen af gasformige reaktanter, hvilket fører til hyppigere kollisioner og en højere reaktionshastighed.
7. Blanding :Effektiv blanding af reaktanter sikrer, at de kommer i kontakt hyppigere, hvilket fremmer hurtigere reaktioner. Grundig omrøring eller omrøring kan forbedre reaktionshastigheden væsentligt.
Ved at manipulere disse faktorer kan kemikere kontrollere og optimere hastigheden af kemiske reaktioner til forskellige formål, såsom industrielle processer, lægemiddelsyntese og bioingeniørapplikationer.
 Varme artikler
Varme artikler
-
 Ny bæredygtig produktionsmetode kan fremme plast og lægemidlerIngeniører fra University of Texas viser deres skoleånd frem ved at støbe den nye, bæredygtigt produceret plastmateriale til en Longhorn-silhuet i Hal Alpers laboratorium. Kredit:Cockrell School of En
Ny bæredygtig produktionsmetode kan fremme plast og lægemidlerIngeniører fra University of Texas viser deres skoleånd frem ved at støbe den nye, bæredygtigt produceret plastmateriale til en Longhorn-silhuet i Hal Alpers laboratorium. Kredit:Cockrell School of En -
 Ny forskning identificerer Fukushima -reaktormateriale i miljøetEt 3D-billede, der tillod forskerne at opdage fordelingen af elementer i prøven. Kredit:University of Bristol/Diamond Light Source Gennem analyse af specifikke nedfaldspartikler i miljøet, et fæ
Ny forskning identificerer Fukushima -reaktormateriale i miljøetEt 3D-billede, der tillod forskerne at opdage fordelingen af elementer i prøven. Kredit:University of Bristol/Diamond Light Source Gennem analyse af specifikke nedfaldspartikler i miljøet, et fæ -
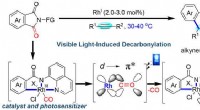 Synligt lys-induceret bifunktionel rhodiumkatalyse udviklet til decarbonylativ kobling af imider med…Lysinduceret bifunktionel rhodiumkatalyse til decarbonylering. Kredit:MIN Xiangting Carbonylgrupper er allestedsnærværende i lægemidler, naturlige produkter, og landbrugskemikalier, især amider. O
Synligt lys-induceret bifunktionel rhodiumkatalyse udviklet til decarbonylativ kobling af imider med…Lysinduceret bifunktionel rhodiumkatalyse til decarbonylering. Kredit:MIN Xiangting Carbonylgrupper er allestedsnærværende i lægemidler, naturlige produkter, og landbrugskemikalier, især amider. O -
 Ioniske faser af ammoniakrig hydrat opdaget ved høje densiteterDet foreslåede fasediagram for AHH baseret på dette brev og lavtryksdata fra Wilson et al. For de eksperimentelle data, forskellige farver skildrer forskellige faser, og forskellige fyldte symboler re
Ioniske faser af ammoniakrig hydrat opdaget ved høje densiteterDet foreslåede fasediagram for AHH baseret på dette brev og lavtryksdata fra Wilson et al. For de eksperimentelle data, forskellige farver skildrer forskellige faser, og forskellige fyldte symboler re


