Hvor mange gram ilt skal der til for at reagere med 23,9 ammoniak?
$$4NH_3 + 5O_2 \højrepil 4NO + 6H_2O$$
Dernæst beregner vi antallet af mol ammoniak ved hjælp af dens molære masse:
$$Moles\ of\ NH_3 =\frac{23,9\ g}{17,04\ g/mol} =1,404\ mol$$
Ifølge den afbalancerede kemiske ligning reagerer 4 mol ammoniak med 5 mol ilt. Derfor kan vi beregne antallet af nødvendige mol ilt:
$$mol\ af\ O_2 =1,404\ mol\ NH_3 \ gange \frac{5\ mol\ O_2}{4\ mol\ NH_3} =1,755\ mol\ O_2$$
Til sidst konverterer vi mol ilt tilbage til gram ved hjælp af dens molære masse:
$$Grams\ af\ O_2 =1,755\ mol \ gange 32,00\ g/mol =56,32\ g$$
Derfor skal der 56,32 gram ilt til for at reagere med 23,9 gram ammoniak.
Sidste artikelReagerer ammoniak med ilt og danner ammoniumoxid?
Næste artikelHvordan kan man få en kemisk reaktion til at gå hurtigere?
 Varme artikler
Varme artikler
-
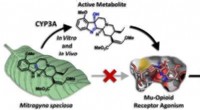 Kratoms anerkendte fordele ved smertelindring kan komme fra en af dets metabolitterKredit:American Chemical Society Kratom er et sydøstasiatisk træ med en lang historie inden for traditionel medicin. I regionen, plantens blade forbruges i vid udstrækning til smertelindring, beha
Kratoms anerkendte fordele ved smertelindring kan komme fra en af dets metabolitterKredit:American Chemical Society Kratom er et sydøstasiatisk træ med en lang historie inden for traditionel medicin. I regionen, plantens blade forbruges i vid udstrækning til smertelindring, beha -
 En motorvej for elektroner i oxidheterostrukturerFigur illustrerer vigtigheden af stærk (elektronisk) screening ved bestemmelse af elektronmobiliteten ved grænseflader af oxidheterostrukturer. Den betydelige forbedring af elektronmobilitet kan mul
En motorvej for elektroner i oxidheterostrukturerFigur illustrerer vigtigheden af stærk (elektronisk) screening ved bestemmelse af elektronmobiliteten ved grænseflader af oxidheterostrukturer. Den betydelige forbedring af elektronmobilitet kan mul -
 Ny metode tillader nem, alsidig syntese af lactonmolekylerKredit:CC0 Public Domain Kemikere ved Scripps Research har afsløret en metode til at omdanne billige og bredt tilgængelige kemikalier kendt som dicarboxylsyrer til potentielt meget værdifulde molek
Ny metode tillader nem, alsidig syntese af lactonmolekylerKredit:CC0 Public Domain Kemikere ved Scripps Research har afsløret en metode til at omdanne billige og bredt tilgængelige kemikalier kendt som dicarboxylsyrer til potentielt meget værdifulde molek -
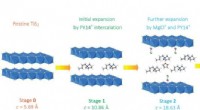 Gennembrud inden for magnesiumbatterier:Nanostruktureret katode, forståelse af ny elektrolyt fører…Skematisk over den strukturelle udvikling af titandisulfid på forskellige stadier af interkalation. Mellemlag udvides eller forvrænges som forskellige mængder af søjlemolekyler, komplekse kationer og
Gennembrud inden for magnesiumbatterier:Nanostruktureret katode, forståelse af ny elektrolyt fører…Skematisk over den strukturelle udvikling af titandisulfid på forskellige stadier af interkalation. Mellemlag udvides eller forvrænges som forskellige mængder af søjlemolekyler, komplekse kationer og
- Dansk kok lancerer gourmetmad til stratosfæren
- Spray af små partikler af guld kan potentielt behandle hjertesygdomme, tyder forskning på
- Hyperloop eller hyperbole? Musk lover at NY-DC kører om 29 minutter
- Sådan renser du New Delhis smoggy luft
- Du efterlader et mikrobe-fingeraftryk på hvert stykke tøj, du har på - og det kan hjælpe retsmed…
- Et fornyet forsøg på at beskytte gravende ugler er på vej:Hvad ændrede sig?


