Hvad er de 3 typer forbindelser og deres eksempler i kemi?
Ioniske forbindelser dannes ved overførsel af elektroner fra et atom til et andet. Den elektrostatiske tiltrækningskraft mellem de positive og negative ioner holder sammensætningen sammen. Ioniske forbindelser er typisk hårde, sprøde og har høje smeltepunkter. Eksempler omfatter natriumchlorid (NaCl), kaliumiodid (KI) og calciumfluorid (CaF2).
Kovalente forbindelser dannes ved deling af elektroner mellem atomer. Den kovalente binding er en stærk binding, der skyldes tiltrækningen mellem de positivt ladede kerner og de negativt ladede elektroner. Kovalente forbindelser er typisk bløde, har lave smeltepunkter og er opløselige i organiske opløsningsmidler. Eksempler omfatter metan (CH4), vand (H2O) og kuldioxid (CO2).
Metalforbindelser dannes af tiltrækningen mellem metalatomer. Den metalliske binding er en svag binding, der skyldes tiltrækningen mellem de positivt ladede metalioner og de negativt ladede elektroner. Metalliske forbindelser er typisk hårde, skinnende og har høje smeltepunkter. Eksempler omfatter kobber (Cu), aluminium (Al) og jern (Fe).
Sidste artikelHvad er problemet med et saltsystem, der genererer klor?
Næste artikelEr saccharose et rent stof eller en blanding?
 Varme artikler
Varme artikler
-
 At omdanne madaffald til bioplastPå UC’s Institut for Kemi- og Procesteknik, Dr. Alex Yip leder forskning i omdannelse af madspild. Kredit:University of Canterbury En genial ny løsning, der bliver udviklet ved University of Cante
At omdanne madaffald til bioplastPå UC’s Institut for Kemi- og Procesteknik, Dr. Alex Yip leder forskning i omdannelse af madspild. Kredit:University of Canterbury En genial ny løsning, der bliver udviklet ved University of Cante -
 Kører du højt? Kemikere gør fremskridt mod marihuana-åndedrætsanalysatorForskernes THC-drevne brændselscellesensor med sit H-formede glaskammer. Kredit:Evan Darzi En kemiker fra UCLA og kolleger er nu et skridt nærmere deres mål om at udvikle et håndholdt værktøj, der
Kører du højt? Kemikere gør fremskridt mod marihuana-åndedrætsanalysatorForskernes THC-drevne brændselscellesensor med sit H-formede glaskammer. Kredit:Evan Darzi En kemiker fra UCLA og kolleger er nu et skridt nærmere deres mål om at udvikle et håndholdt værktøj, der -
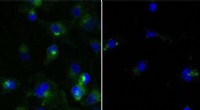 Cellulær oprydning kan også feje former for kræft vækCeller ubehandlet (venstre) eller behandlet (højre) med en PROTAC, der nedbryder målproteinet (grønt). Kredit:Yale University To nye forskningsartikler forstærker fordelene ved en ny terapi, der k
Cellulær oprydning kan også feje former for kræft vækCeller ubehandlet (venstre) eller behandlet (højre) med en PROTAC, der nedbryder målproteinet (grønt). Kredit:Yale University To nye forskningsartikler forstærker fordelene ved en ny terapi, der k -
 Nyt lys kastede over intenst studeret materialeIgor Zozoulenko, professor og leder af teori- og modelleringsgruppen ved Laboratoriet for Organisk Elektronik, Linköpings Universitet. Kredit:Peter Holgersson Den organiske polymer PEDOT er et af
Nyt lys kastede over intenst studeret materialeIgor Zozoulenko, professor og leder af teori- og modelleringsgruppen ved Laboratoriet for Organisk Elektronik, Linköpings Universitet. Kredit:Peter Holgersson Den organiske polymer PEDOT er et af
- Hvorfor tilsættes syre til vand og ikke syre?
- Opdagelse af ældgamle klippeindtryk tyder på, at evnen til at danne forhornet hud går tilbage til…
- Indeholder kulstof fire ionbindinger i dets forbindelser?
- Sådan stopper du en brand Sprinkler
- Forskellige former for vejrforhold
- En samtale kunne være svaret på en vellykket rehabilitering af fanger


