Hvilken type binding forekommer i klor?
I klormolekyler deler hvert kloratom en elektron med et andet kloratom, hvilket resulterer i en enkelt kovalent binding. Denne kovalente binding dannes ved overlapning af atomorbitaler af de to kloratomer, hvilket resulterer i deling af et elektronpar. Den kovalente binding i klormolekyler er ret stærk, hvorfor klor er en stabil diatomisk gas ved stuetemperatur.
Den kovalente binding i chlor kan også repræsenteres ved hjælp af en Lewis-struktur. I en Lewis-struktur er atomernes valenselektroner repræsenteret af prikker placeret rundt om atomsymbolerne. For et klormolekyle er Lewis-strukturen som følger:
```
Cl - Cl
```
Denne Lewis-struktur viser, at hvert chloratom har syv valenselektroner, hvor en elektron deles mellem de to chloratomer for at danne en kovalent binding.
Sidste artikelHvilken type binding opstår mellem si og s?
Næste artikelHvad er absolutte saltkoncentrationer?
 Varme artikler
Varme artikler
-
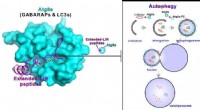 Forskere opdager autofagi-hæmmende peptider fra gigantiske ankyrinerDette visuelle abstrakt præsenterer de superstærke Atg8s-bindende peptider, der effektivt kan hæmme autofagi. Kredit:Division of Life Science, HKUST Autofagi, betyder selvspisning på græsk, er en
Forskere opdager autofagi-hæmmende peptider fra gigantiske ankyrinerDette visuelle abstrakt præsenterer de superstærke Atg8s-bindende peptider, der effektivt kan hæmme autofagi. Kredit:Division of Life Science, HKUST Autofagi, betyder selvspisning på græsk, er en -
 Ætsning af vejen til en brintøkonomi ved hjælp af plasmastrålerEt skridt tættere på en effektiv måde at producere brint på, så vi endelig kan undvære fossile brændstoffer og andre energikilder, der er skadelige for vores planet Kredit:Tokyo University of Science
Ætsning af vejen til en brintøkonomi ved hjælp af plasmastrålerEt skridt tættere på en effektiv måde at producere brint på, så vi endelig kan undvære fossile brændstoffer og andre energikilder, der er skadelige for vores planet Kredit:Tokyo University of Science -
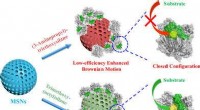 Enzymkonformation påvirker ydeevnen af lipase-drevne nanomotorerKredit:Angewandte Chemie En undersøgelse foretaget af forskere ved Centro Nacional de Investigaciones Cardiovasculares (CNIC), Universidad Complutense (UCM), Universidad de Girona (UdG), og Instit
Enzymkonformation påvirker ydeevnen af lipase-drevne nanomotorerKredit:Angewandte Chemie En undersøgelse foretaget af forskere ved Centro Nacional de Investigaciones Cardiovasculares (CNIC), Universidad Complutense (UCM), Universidad de Girona (UdG), og Instit -
 Stabilisering af en klippe ved hjælp af biominerale bindemidlerKredit:Ecole Polytechnique Federale de Lausanne EPFL-spin-off Medusoil har med succes testet sin jordstabiliseringsproces på klipper udsat for overfladeerosion. Virksomhedens biomineralbaserede lø
Stabilisering af en klippe ved hjælp af biominerale bindemidlerKredit:Ecole Polytechnique Federale de Lausanne EPFL-spin-off Medusoil har med succes testet sin jordstabiliseringsproces på klipper udsat for overfladeerosion. Virksomhedens biomineralbaserede lø
- Forskere kaster sig ud i havets skumringszone for at udforske økosystemets kulstofstrøm
- Forskere finder overraskende resultater, når de ser på virkningerne af kulstofnanorør og jordsorp…
- Forskere undersøger kvantenetværksløsninger, via jorden og ad luftvejen
- Kunstige enzymer omdanner solenergi til hydrogengas
- Sundt at spise, usundt at dyrke — Jordbær legemliggør modsætningerne i californisk landbrug
- Tvivl på selv og isolation, men også modstandsdygtighed blandt nye lærere på grund af pandemi, f…


