N2 plus 3H2 -- 2NH3 Hvis du producerer 55,5 gram ammoniak, hvor meget nitrogen skal du bruge?
Den afbalancerede kemiske ligning er:
N2 + 3H2 -> 2NH3
Først skal vi omdanne massen af ammoniak til mol ved hjælp af dens molære masse. Den molære masse af NH3 er 14,01 gram/mol (14 gram nitrogen og 3 gram brint).
Mol af NH3 =Masse af NH3 / Molær masse af NH3
Mol NH3 =55,5 gram / 17,04 gram/mol
Mol NH3 =3,26 mol
Ifølge den afbalancerede kemiske ligning kræves der 1 mol N2 for at producere 2 mol NH3. Så vi kan beregne antallet af nødvendige mol N2:
Mol af N2 =Mol af NH3 / 2
Mol N2 =3,26 mol / 2
Mol N2 =1,63 mol
Nu kan vi konvertere mol N2 tilbage til gram ved hjælp af dens molære masse. Den molære masse af N2 er 28,02 gram/mol (2 x 14 gram nitrogen).
Masse af N2 =Mol af N2 * Molær masse af N2
Masse af N2 =1,63 mol * 28,02 gram/mol
Masse af N2 =45,68 gram
Derfor skal der 45,68 gram nitrogen (N2) til for at producere 55,5 gram ammoniak (NH3).
 Varme artikler
Varme artikler
-
 Kemisk fingeraftryk med høj præcision tillader entydig identifikationKredit:CC0 Public Domain Komponenter på 42 vine er blevet analyseret ved hjælp af topmoderne udstyr for første gang. De genererede data vil give et ekstremt nøjagtigt grundlag for en definitiv kar
Kemisk fingeraftryk med høj præcision tillader entydig identifikationKredit:CC0 Public Domain Komponenter på 42 vine er blevet analyseret ved hjælp af topmoderne udstyr for første gang. De genererede data vil give et ekstremt nøjagtigt grundlag for en definitiv kar -
 Kemiker forklarer videnskaben bag fyrværkeriUanset om du vil se fyrværkeri langs Bostons Esplanade eller et andet sted den fjerde juli, du vil ikke være den eneste, der slapper af denne ferie. Det er fordi fyrværkeri, forklarede Michael Pollas
Kemiker forklarer videnskaben bag fyrværkeriUanset om du vil se fyrværkeri langs Bostons Esplanade eller et andet sted den fjerde juli, du vil ikke være den eneste, der slapper af denne ferie. Det er fordi fyrværkeri, forklarede Michael Pollas -
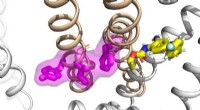 Undersøgelse afslører en ny mekanisme bag epilepsi og lægemiddelmoduleringForskere i Jianmin Cuis laboratorium har set på mekanismerne bag funktionen og dysfunktionen af en gruppe proteiner, samt deres interaktioner med et antiepileptisk lægemiddel, for at udvikle en pote
Undersøgelse afslører en ny mekanisme bag epilepsi og lægemiddelmoduleringForskere i Jianmin Cuis laboratorium har set på mekanismerne bag funktionen og dysfunktionen af en gruppe proteiner, samt deres interaktioner med et antiepileptisk lægemiddel, for at udvikle en pote -
 Magnetiske T-Budbots lavet af teplanter dræber og renser biofilmKredit:Pixabay/CC0 Public Domain Biofilm - mikrobielle samfund, der danner slimede lag på overflader - er svære at behandle og fjerne, ofte fordi mikroberne frigiver molekyler, der blokerer for in
Magnetiske T-Budbots lavet af teplanter dræber og renser biofilmKredit:Pixabay/CC0 Public Domain Biofilm - mikrobielle samfund, der danner slimede lag på overflader - er svære at behandle og fjerne, ofte fordi mikroberne frigiver molekyler, der blokerer for in
- McDonalds står over for betydelige udfordringer i forsøget på at servere kunstig intelligens med …
- Ny og verificeret computermodel forbedrer bearbejdning af nanoskala halvlederdele til elektronikindu…
- Specialdesignet legering øger nuklear sikkerhed
- Sådan beregnes den Wetted Perimeter
- Accelereret arkitektur i Americas hurtigste supercomputer øger QCD -simuleringer
- Opdagelse af kvanteadfærd i isolatorer antyder mulige nye partikler


