Undersøgelse afslører en ny mekanisme bag epilepsi og lægemiddelmodulering
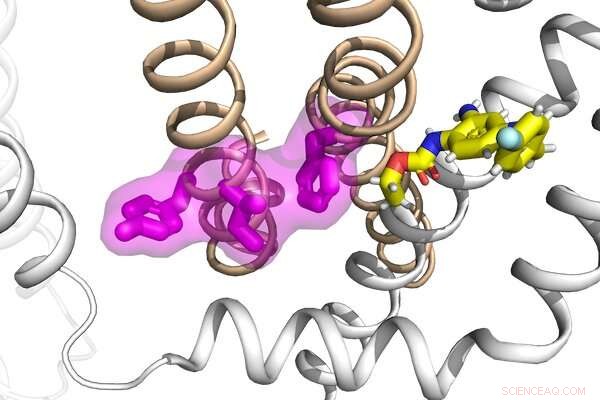
Forskere i Jianmin Cuis laboratorium har set på mekanismerne bag funktionen og dysfunktionen af en gruppe proteiner, samt deres interaktioner med et antiepileptisk lægemiddel, for at udvikle en potentiel ny strategi til behandling af epilepsi. Kredit:Cui lab
Epilepsi er en neurologisk lidelse, der opstår som følge af unormal elektrisk aktivitet i hjernen, der fører til anfald. Disse anfald kan have en række forskellige årsager, herunder genetiske varianter i en familie af proteiner, der regulerer kaliumioner i hjernen. Forskere ved Washington University i St. Louis har ledet et internationalt hold til at se nærmere på mekanismerne bag disse proteiners funktion og dysfunktion, samt deres interaktioner med et antiepileptisk lægemiddel, for at udvikle en potentiel ny strategi til behandling af epilepsi.
Jianmin Cui, professor i biomedicinsk ingeniørvidenskab ved McKelvey School of Engineering, og Nien-Du Yang, en doktorand i biomedicinsk ingeniørvidenskab, som forsker i Cuis laboratorium, gik sammen med Harley Kurata, lektor i farmakologi ved University of Alberta, og undersøgte arbejdsmekanismen for to kaliumionkanaler, KCNQ2 og KCNQ3. Deres resultater afslører en bevaret mekanisme for KCNQ-kanalaktivering, der er et mål for både epilepsi-forbundne mutationer og en lille molekyleforbindelse.
Værket blev offentliggjort den 20. juli i Science Advances .
KCNQ-kaliumkanalfamilien har flere funktioner, fra regulering af hjerteslag (ved KCNQ1) til styring af nervecellers excitabilitet (ved KCNQ2-5). Disse kanaler er spændingsaktiverede, så de registrerer spændingsændringer over cellemembranen og åbner og lukker som reaktion. Kommunikationen mellem spændingsføling og kanalporeåbning er kendt som elektromekanisk kobling, en proces, der involverer konformationelle ændringer af proteinet under spændingsafhængig aktivering.
Cuis team har tidligere vist, at KCNQ1, hjerte-KCNQ-isoformen, har en to-trins proces i elektro-mekanisk kobling, der fører til to distinkte kanal åbne tilstande, den mellemliggende åben og aktiveret-åben. Regulering af de to åbne tilstande ligger til grund for KCNQ1's vævsspecifikke moduleringer, sygdomspatogenese og farmakologi. KCNQ2 og KCNQ3 er stærkt udtrykt i centralnervesystemet og er de vigtigste bidragydere til M-strømmen, en kritisk kaliumstrøm, der modulerer neuronal excitabilitet. Derfor er nedsat M-strøm funktion af medfødte mutationer i KCNQ2 og KCNQ3 almindeligvis forbundet med tidligt indsættende og pædiatrisk epilepsi.
"Selvom KCNQ-kanaler er meget ens i deres sekvenser og strukturer, er det uklart, om de neuronale KCNQ-isoformer også deler den samme elektromekaniske koblingsmekanisme eller to åbne tilstande," sagde Yang, avisens første forfatter. "Dette arbejde afslører vigtige ligheder og forskelle mellem disse kanaler, som kan have vigtige konsekvenser for deres funktion i kardiomyocytter eller neuroner."
Holdet brugte en række forskellige metoder til at studere den elektromekaniske koblingsmekanisme i disse kaliumkanaler, herunder at skabe specifikke genetiske mutationer i kanalerne, elektrofysiologi og optiske fluorescensmålinger.
"At belyse den molekylære mekanisme for elektromekanisk kobling er et vigtigt skridt i retning af at forstå den spændingsafhængige gating af kaliumkanaler," sagde Cui. "Vi leverede funktionelt bevis på, at de neuronale KCNQ2- og KCNQ3-kanaler er forskellige fra KCNQ1, hvor de har en enkelt aktiveret-åben tilstand, men med en bevaret elektromekanisk koblingsmekanisme, der er specifik for den aktiverede-åben tilstand."
Disse kanaler er primære mål for behandlinger af epilepsi, fandt forskerne. Holdet identificerede også et sæt mutationer i KCNQ2 og KCNQ3 forbundet med tidlig infantil epileptisk encefalopati, en alvorlig form for børneepilepsi, der specifikt forstyrrer den elektromekaniske kobling af kanalerne. Forskerne udnyttede en antiepileptisk prototype af lægemiddel retigabin i betragtning af dets virkningsmekanisme på neuronale KCNQ-kanaler og demonstrerede, at den elektromekaniske kobling direkte kan forbedres for at redde funktionen af disse syge mutanter. Deres undersøgelser tyder på, at den elektromekaniske koblingsmekanisme i KCNQ-kanaler kan være et effektivt mål, der præsenterer en ny farmakologisk strategi til udvikling af mere effektive terapier til epilepsibehandling. + Udforsk yderligere
Kaliumkanaldysfunktion ved genetisk epilepsi
 Varme artikler
Varme artikler
-
 NIST-opdagelse kan øge nøjagtigheden ved måling af blodgennemstrømning til kræftdiagnose, andre…Akustiske overfladebølger (SAW) bevæger sig gennem en mikrovæske begrænset til et hulrum eller en mikrokanal og analyseres derefter af modtageren. Både den akustiske bølgesender (SPUDT) og modtageren
NIST-opdagelse kan øge nøjagtigheden ved måling af blodgennemstrømning til kræftdiagnose, andre…Akustiske overfladebølger (SAW) bevæger sig gennem en mikrovæske begrænset til et hulrum eller en mikrokanal og analyseres derefter af modtageren. Både den akustiske bølgesender (SPUDT) og modtageren -
 Nyt lægemiddel kunne forhindre invaliderende bivirkning af kræftbehandlingPladsfyldende struktur skildring af GC4419 baseret på røntgenkrystalstrukturbestemmelse. Kredit:Dennis Riley Omkring 50, 000 mennesker i USA diagnosticeres årligt med hoved, nakke, kræft i næsen o
Nyt lægemiddel kunne forhindre invaliderende bivirkning af kræftbehandlingPladsfyldende struktur skildring af GC4419 baseret på røntgenkrystalstrukturbestemmelse. Kredit:Dennis Riley Omkring 50, 000 mennesker i USA diagnosticeres årligt med hoved, nakke, kræft i næsen o -
 Bygninger – Beton på det dobbelteORNL forskere brugte fiberforstærkninger lavet af stål, glas og kulstof for at udvikle en betonblanding, der viste høj tidlig styrke inden for seks timer efter produktion, som er nødvendig for den præ
Bygninger – Beton på det dobbelteORNL forskere brugte fiberforstærkninger lavet af stål, glas og kulstof for at udvikle en betonblanding, der viste høj tidlig styrke inden for seks timer efter produktion, som er nødvendig for den præ -
 En superopløsningsvisning af kemiske reaktionerDen nye metode til dataanalyse fra superopløsningsfluorescenskorrelationsmikroskopi er blevet verificeret, blandt andre, i forsøg, der efterligner det biologiske miljø. Forskere observerede små fluore
En superopløsningsvisning af kemiske reaktionerDen nye metode til dataanalyse fra superopløsningsfluorescenskorrelationsmikroskopi er blevet verificeret, blandt andre, i forsøg, der efterligner det biologiske miljø. Forskere observerede små fluore
- Big data på den sociale medieplatform afslører positive ansigtsudtryk af kvindelige besøgende i b…
- Kan patriarkatet være matrilineært? En antropolog efterlyser klarhed
- Dage med ekstrem nedbør i storbyen Sao Paulo er firedoblet på syv årtier
- Visualisering af global repræsentation for oprindelige nationer
- Athen brander blandt de dødeligste i Europa i dette århundrede
- Forskere har sporet Jordens vej gennem galaksen via små krystaller fundet i dens skorpe


