Hvor mange milliliter 0,45 M HCL vil neutralisere 25,0 ml 1,00 M KOH?
```
HCl + KOH → KCl + H2O
```
Reaktionens støkiometri viser, at 1 mol HCl reagerer med 1 mol KOH. Derfor er antallet af mol HCl, der kræves for at neutralisere 25,0 ml 1,00M KOH:
```
mol HCI =(25,0 ml / 1000) * 1,00 M =0,0250 mol
```
Koncentrationen af HCl-opløsningen er 0,45 M, så det volumen HCl, der kræves for at give 0,0250 mol HCl, er:
```
volumen HCI =(0,0250 mol / 0,45 M) * 1000 =55,6 ml
```
Derfor kræves 55,6 ml 0,45 M HCI for at neutralisere 25,0 ml 1,00 M KOH.
 Varme artikler
Varme artikler
-
 Field-cycling relaxometry kan vurdere tumorstatus ved at måle hastigheden af cellulær vandudveks…Hvor aggressiv er en tumor? For at måle tumorstatus uden at tage vævsprøver, Italienske forskere har udviklet en metode baseret på magnetisk resonansbilleddannelse (MRI) af hele kropsdele. Teknikken m
Field-cycling relaxometry kan vurdere tumorstatus ved at måle hastigheden af cellulær vandudveks…Hvor aggressiv er en tumor? For at måle tumorstatus uden at tage vævsprøver, Italienske forskere har udviklet en metode baseret på magnetisk resonansbilleddannelse (MRI) af hele kropsdele. Teknikken m -
 Indlejret dråbeprint-teknologi udskriver og behandler kontrollerbart dråber, der er suspenderet på…Den nye indlejrede metode til udskrivning af dråber suspenderer 3D-arrays af dråber i en unikt isoleret tilstand, der giver mulighed for præcis behandling og eksperimentering Kredit:Singapore-MIT Alli
Indlejret dråbeprint-teknologi udskriver og behandler kontrollerbart dråber, der er suspenderet på…Den nye indlejrede metode til udskrivning af dråber suspenderer 3D-arrays af dråber i en unikt isoleret tilstand, der giver mulighed for præcis behandling og eksperimentering Kredit:Singapore-MIT Alli -
 Min ambition? En anden nobelpris siger kemipristagerCharpentier modtog sit Nobeldiplom og medalje af Per Thoresson, den svenske ambassadør i Tyskland, i Berlin på mandag At vinde Nobelprisen er ofte toppen af professionel præstation, men kemipris
Min ambition? En anden nobelpris siger kemipristagerCharpentier modtog sit Nobeldiplom og medalje af Per Thoresson, den svenske ambassadør i Tyskland, i Berlin på mandag At vinde Nobelprisen er ofte toppen af professionel præstation, men kemipris -
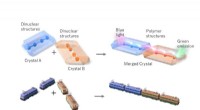 Linkede lanthanider skinner lys på krystalteknikNår blåt lys skinner på dysprosiumenden af forbundne lanthanidkrystaller (blå krystal), lyser terbiumenden (orange krystal) grønt. Dette sammenlignes med et tog, der transporterer energi. Kredit:Ped
Linkede lanthanider skinner lys på krystalteknikNår blåt lys skinner på dysprosiumenden af forbundne lanthanidkrystaller (blå krystal), lyser terbiumenden (orange krystal) grønt. Dette sammenlignes med et tog, der transporterer energi. Kredit:Ped
- Empatiens magt i produktudvikling
- Sådan virker Luminol
- Forskere foretager første detaljerede målinger af nøglefaktorer relateret til høj temperatur sup…
- Ny bærbar, højtydende enhed analyserer giftige gasser og luftforurenende stoffer
- Hvad er den elektroniske konfiguration af negativ ion Cl?
- Elektrokemisk tuning af enkeltlagsmaterialer er afhængig af defekter


