Hvad er typen hybridisering af kulstof i CH3CHCH2?
Kulstofatomerne i CH3CHCH2-molekylet er alle sp2-hybridiseret. Det betyder, at hvert kulstofatom har tre sp2 hybridorbitaler og en p orbitaler. Sp2 hybrid orbitaler dannes ved blanding af en s orbitaler og to p orbitaler. p-orbitalen er vinkelret på planet for sp2-hybridorbitalerne.
Sp2-hybridorbitalerne af carbonatomerne i CH3CHCH2-molekylet bruges til at danne sigma-bindinger med hydrogenatomerne og de andre carbonatomer. Kulstofatomernes p-orbitaler bruges til at danne pi-bindinger med hinanden.
Sp2-hybridiseringen af carbonatomerne i CH3CHCH2-molekylet resulterer i en trigonal plan molekylær geometri. Det betyder, at de tre kulstofatomer og de tre brintatomer, der er bundet til hvert kulstofatom, ligger i et plan.
 Varme artikler
Varme artikler
-
 Forskere udvider mekanismen til at knække biokemisk kodeGrafisk viser sekvenser for peptidklynger. Kredit:University of California San Diego Siden tiden i det gamle Egypten, mennesker har lavet og brudt hemmelige koder for at bevare og få kritisk infor
Forskere udvider mekanismen til at knække biokemisk kodeGrafisk viser sekvenser for peptidklynger. Kredit:University of California San Diego Siden tiden i det gamle Egypten, mennesker har lavet og brudt hemmelige koder for at bevare og få kritisk infor -
 Forskere udvikler enzym fremstillet af landbrugsaffald til brug som vaskemiddelDr. Pattanathu Rahman. Kredit:University of Portsmouth Et internationalt forskerhold har udviklet et enzym fremstillet af landbrugsaffald, der kunne bruges som et vigtigt tilsætningsstof i vaskemi
Forskere udvikler enzym fremstillet af landbrugsaffald til brug som vaskemiddelDr. Pattanathu Rahman. Kredit:University of Portsmouth Et internationalt forskerhold har udviklet et enzym fremstillet af landbrugsaffald, der kunne bruges som et vigtigt tilsætningsstof i vaskemi -
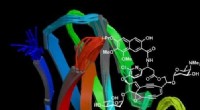 Forskere er verdens første til at reproducere en komplet kopi af anti-tumor-antibiotikumBillede der viser kromoproteinet på Kedarcidin, et komplekst anti-tumor-antibiotikum, som forskerne har reproduceret syntetisk i laboratoriet for første gang. Kredit:Professor Martin Lear, University
Forskere er verdens første til at reproducere en komplet kopi af anti-tumor-antibiotikumBillede der viser kromoproteinet på Kedarcidin, et komplekst anti-tumor-antibiotikum, som forskerne har reproduceret syntetisk i laboratoriet for første gang. Kredit:Professor Martin Lear, University -
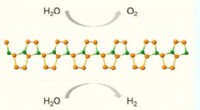 Tid til en ny konkurrent inden for energiomdannelse og lagringKAUST-teamet brugte state-of-the-art evolutionær søgning og beregninger af første principper til at forudsige strukturen af B 2 P 6 . Kredit:KAUST Evolutionær søgning har hjulpet forskere me
Tid til en ny konkurrent inden for energiomdannelse og lagringKAUST-teamet brugte state-of-the-art evolutionær søgning og beregninger af første principper til at forudsige strukturen af B 2 P 6 . Kredit:KAUST Evolutionær søgning har hjulpet forskere me
- Oversvømmelse:Er det på tide at stoppe med at bo i kældre?
- Fundet probe celle samarbejde, en masse migration
- Hvordan varierer viskositeten af væsker med trykket?
- Forbyd ikke nye teknologier – eksperimenter omhyggeligt med dem
- Forskere finder værdi i usædvanlig type plantemateriale
- Hvordan udfører Corn Stivelse og Speaker Experiment


