Hvordan varierer viskositeten af væsker med trykket?
Det omvendte forhold mellem viskositet og tryk kan forklares ved væskers molekylære struktur. Væsker består af molekyler, der holdes sammen af intermolekylære kræfter, såsom van der Waals-kræfter, hydrogenbindinger eller ionbindinger. Når der påføres tryk på en væske, bliver de intermolekylære kræfter mellem molekylerne stærkere, hvilket får dem til at pakkes tættere sammen og reducerer den plads, der er til rådighed for dem til at bevæge sig forbi hinanden. Dette resulterer i et fald i væskens viskositet.
Den hastighed, hvormed viskositeten falder med stigende tryk, varierer afhængigt af væsketypen og temperaturen. For de fleste væsker er faldet i viskositet med tryk mere signifikant ved lavere temperaturer. Dette skyldes, at de intermolekylære kræfter mellem molekylerne er stærkere ved lavere temperaturer, hvilket gør dem mere modstandsdygtige over for påvirkningerne af tryk.
Sammenfattende falder væskers viskositet generelt med stigende tryk på grund af den tættere pakning af molekyler og reduceret modstand mod strømning. Dog afhænger hastigheden af fald i viskositet med tryk af den specifikke væske og temperaturen.
 Varme artikler
Varme artikler
-
 Ny måde at reducere ardannelser i huden er afhængig af et limlignende stof, der udskilles af musli…Perna viridis muslinger. Kredit:Wikipedia (Phys.org) – Et team af forskere ved Pohang University of Science and Technology i Sydkorea har udviklet en ny hudapplikation designet til at reducere ard
Ny måde at reducere ardannelser i huden er afhængig af et limlignende stof, der udskilles af musli…Perna viridis muslinger. Kredit:Wikipedia (Phys.org) – Et team af forskere ved Pohang University of Science and Technology i Sydkorea har udviklet en ny hudapplikation designet til at reducere ard -
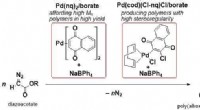 Nye palladium-baserede initieringssystemer til C1-polymerisation af diazoacetaterC1-polymerisation af diazoacetater med nye Pd-baserede initieringssystemer. Kredit:Ehime University Et forskerhold ved Ehime University fandt ud af, at nye initieringssystemer bestående af palladi
Nye palladium-baserede initieringssystemer til C1-polymerisation af diazoacetaterC1-polymerisation af diazoacetater med nye Pd-baserede initieringssystemer. Kredit:Ehime University Et forskerhold ved Ehime University fandt ud af, at nye initieringssystemer bestående af palladi -
 Stivelse kan erstatte almindelig plast i fødevareemballageKredit:Karlstad Universitet På sigt skal alt petroleumsbaseret materiale i fødevareemballage erstattes med biobaseret materiale. Forskning udført ved Karlstad Universitet viser, at en blanding af
Stivelse kan erstatte almindelig plast i fødevareemballageKredit:Karlstad Universitet På sigt skal alt petroleumsbaseret materiale i fødevareemballage erstattes med biobaseret materiale. Forskning udført ved Karlstad Universitet viser, at en blanding af -
 Tandem katalytisk system omdanner effektivt kuldioxid til methanolKredit:Frank Tsung Omdannelse af kuldioxid til methanol, et potentielt vedvarende alternativt brændstof, giver mulighed for samtidig at danne et alternativt brændstof og skære ned på udledningen a
Tandem katalytisk system omdanner effektivt kuldioxid til methanolKredit:Frank Tsung Omdannelse af kuldioxid til methanol, et potentielt vedvarende alternativt brændstof, giver mulighed for samtidig at danne et alternativt brændstof og skære ned på udledningen a
- Hvordan man fortæller Mand & Kvinde Zebrafish Apart
- Mere end en carbonkopi:OCO-3 på rumstationen
- Matematisk model efterligner melanom
- Studielånsgælden er stadig en lammende byrde for millioner af amerikanere
- Hvad er den kemiske test for stål?
- Forskere beskriver hele udvalget af ceramider, der findes i det øverste lag af menneskelig hud


