Hvad har de stoffer, der leder elektricitet, når de er opløst, til fælles?
1. Ioniske forbindelser: Elektrolytter er typisk ioniske forbindelser, hvilket betyder, at de indeholder positivt ladede ioner (kationer) og negativt ladede ioner (anioner). Når disse forbindelser opløses i vand, adskilles ionerne, så de kan bevæge sig frit i opløsningen.
2. Dissociation: Når en elektrolyt opløses i vand, gennemgår den en proces kaldet dissociation. Under dissociation brydes de ioniske bindinger mellem kationerne og anionerne og frigiver individuelle ioner i opløsningen.
3. Fri ioner: Tilstedeværelsen af frie ioner i opløsningen er det, der gør elektrolytter i stand til at lede elektricitet. Når en elektrisk strøm påføres, bevæger de positivt ladede kationer sig mod den negative elektrode (katode), mens de negativt ladede anioner bevæger sig mod den positive elektrode (anode). Denne bevægelse af ioner udgør en elektrisk strøm.
4. Løsninger: Elektrolytter er stoffer, der kun leder elektricitet i form af opløsninger. I fast tilstand leder elektrolytter ikke elektricitet effektivt, fordi deres ioner er fikseret i et krystalgitter og ikke kan bevæge sig frit.
5. Stærke vs. svage elektrolytter: Elektrolytter kan klassificeres i to typer:stærke elektrolytter og svage elektrolytter. Stærke elektrolytter dissocierer fuldstændigt i vand og frigiver alle deres ioner, mens svage elektrolytter kun delvist dissocierer og efterlader nogle af deres ioner bundet sammen.
Eksempler på almindelige elektrolytter omfatter bordsalt (natriumchlorid), sukker (saccharose) og syrer (såsom saltsyre) eller baser (såsom natriumhydroxid), når de er opløst i vand. Disse stoffer indeholder opløste ioner, der kan bevæge sig frit, så de kan lede elektricitet.
 Varme artikler
Varme artikler
-
 Sutters biosensor kan hjælpe med at overvåge nyfødtes sundhedEn sutebiosensor kan engang bruges til ikke-invasivt at overvåge glukose i spyt hos spædbørn. Kredit:Tilpasset fra Analytisk kemi 2019, DOI:10.1021/acs.analchem.9b03379 Bærbare biosensorer, der
Sutters biosensor kan hjælpe med at overvåge nyfødtes sundhedEn sutebiosensor kan engang bruges til ikke-invasivt at overvåge glukose i spyt hos spædbørn. Kredit:Tilpasset fra Analytisk kemi 2019, DOI:10.1021/acs.analchem.9b03379 Bærbare biosensorer, der -
 Når livet giver dig citroner, lave bioplastLimonen kan være nøglen til nye, miljøvenlige polymerer. Kredit:Public domain Fra dit telefoncover til flyvinduer, polycarbonater er overalt. Flere millioner tons polycarbonat produceres hvert år
Når livet giver dig citroner, lave bioplastLimonen kan være nøglen til nye, miljøvenlige polymerer. Kredit:Public domain Fra dit telefoncover til flyvinduer, polycarbonater er overalt. Flere millioner tons polycarbonat produceres hvert år -
 En plastikfilm, der kan dræbe vira ved hjælp af rumlysGrafisk abstrakt. Kredit:Journal of Photochemistry and Photobiology B:Biology (2022). DOI:10.1016/j.jphotobiol.2022.112551 Forskere ved Queens University Belfast har udviklet en plastikfilm, der ka
En plastikfilm, der kan dræbe vira ved hjælp af rumlysGrafisk abstrakt. Kredit:Journal of Photochemistry and Photobiology B:Biology (2022). DOI:10.1016/j.jphotobiol.2022.112551 Forskere ved Queens University Belfast har udviklet en plastikfilm, der ka -
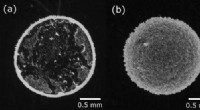 Cellulose -nanofibre kan hjælpe partikler i blæk og trykt elektronik med at sprede sig jævntFotografier af tørrede kolloide blandinger af polystyrenpartikler (diameter 1,4 µm) og cellulosefibre (diameter ca. 20 nm, længde ca. 1 µm). Polystyrenkoncentrationen er fastsat til 0,1 vægtprocent, o
Cellulose -nanofibre kan hjælpe partikler i blæk og trykt elektronik med at sprede sig jævntFotografier af tørrede kolloide blandinger af polystyrenpartikler (diameter 1,4 µm) og cellulosefibre (diameter ca. 20 nm, længde ca. 1 µm). Polystyrenkoncentrationen er fastsat til 0,1 vægtprocent, o
- Multidimensionel undersøgelse tilbyder ny vision for optisk teknologi
- Ingen undslippende havplastik:37 millioner stumper affald på en af verdens fjerneste øer
- Hvor længe vil avancerede civilisationer forsøge at kommunikere med os?
- Modellering af overfladekemi og forudsigelse af nye materialer
- Bedre kemi gennem bittesmå antenner
- Hvordan kommer nitrogen fra levende organismer tilbage til luften?


