Hvorfor er gasformigt nitrogen mindre reaktivt end fluor?
1. Tredobbelt bindingsstyrke: Nitrogenatomer i N2-molekyler holdes sammen af en stærk tredobbeltbinding, som er en af de stærkeste kemiske bindinger. Bindingsdissociationsenergien for N-N-binding i N2 er ca. 946 kJ/mol, hvilket er meget højere sammenlignet med bindingsdissociationsenergien for F-F-binding i F2 (159 kJ/mol). Denne stærke tredobbelte binding gør nitrogen mindre reaktiv over for mange kemiske reaktioner.
2. Høj elektronegativitet af fluor: Fluor er det mest elektronegative element i det periodiske system, hvilket betyder, at det har en stærk tendens til at tiltrække elektroner. Denne høje elektronegativitet gør det muligt for fluor let at danne bindinger med andre elementer, herunder nitrogen. I modsætning hertil har nitrogen en lavere elektronegativitet, hvilket gør det mindre sandsynligt at deltage i bindingsdannelse med andre elementer.
3. Inert pareffekt: I tilfælde af nitrogen er de yderste elektroner (2p elektroner) parrede og relativt stabile. Dette fænomen er kendt som den inerte pareffekt. På grund af denne effekt er de yderste elektroner i nitrogen mindre tilgængelige for binding med andre atomer, hvilket gør det mindre reaktivt. Fluor udviser på den anden side ikke en signifikant inert pareffekt, og dets yderste elektroner er mere tilgængelige for bindingsdannelse.
4. Fravær af d orbitaler: Nitrogenatomer har ikke d-orbitaler i deres valensskal, hvilket begrænser deres evne til at deltage i visse typer kemiske reaktioner. d Orbitaler er essentielle for mange vigtige bindingsinteraktioner, såsom koordinationskomplekser og pi-backbonding. Fluor, på den anden side, tilhører gruppe 17 og har et komplet sæt af valens orbitaler, herunder d orbitaler, som gør det muligt at deltage i en bredere vifte af kemiske reaktioner.
5. Molekylstørrelse: Nitrogenmolekyler (N2) er relativt små og kompakte sammenlignet med fluormolekyler (F2). Den kompakte struktur af N2 gør den mindre tilgængelig for andre molekyler eller atomer at reagere med, hvilket reducerer dens samlede reaktivitet. Fluormolekyler, der er mindre i størrelse, har et større overfladeareal og er mere tilgængelige for interaktioner med andre stoffer, hvilket fører til højere reaktivitet.
Sammenfattende bidrager kombinationen af en stærk tripelbinding, høj elektronegativitet af fluor, inert pareffekt, fravær af d-orbitaler og molekylstørrelsesforskelle til den lavere reaktivitet af gasformigt nitrogen sammenlignet med fluor.
Sidste artikelHvilke opløsningsmidler bruges til at opløse kanelaldehyd?
Næste artikelHvad er en hydreret forbindelse?
 Varme artikler
Varme artikler
-
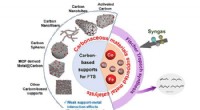 Kulstofbaserede katalysatorer anvendt til Fischer-Tropsch synteseKulstofholdige materialer understøtter metalkatalysatorer til FTS. Kredit:CHEN Yanping og WEI Jiatong Fischer-Tropsch-syntese (FTS) er en vigtig tilgang til omdannelse af kul, biomasse, og skiferg
Kulstofbaserede katalysatorer anvendt til Fischer-Tropsch synteseKulstofholdige materialer understøtter metalkatalysatorer til FTS. Kredit:CHEN Yanping og WEI Jiatong Fischer-Tropsch-syntese (FTS) er en vigtig tilgang til omdannelse af kul, biomasse, og skiferg -
 Brugereksperiment hos BESSY II—komplekse tesselleringer, ekstraordinære materialerDen nye byggeklods (venstre, rødt omrids) omfatter to modificerede startmolekyler forbundet med hinanden med et sølvatom (blåt). Dette fører til komplekse, semiregulære tesseller (højre, mikroskopbill
Brugereksperiment hos BESSY II—komplekse tesselleringer, ekstraordinære materialerDen nye byggeklods (venstre, rødt omrids) omfatter to modificerede startmolekyler forbundet med hinanden med et sølvatom (blåt). Dette fører til komplekse, semiregulære tesseller (højre, mikroskopbill -
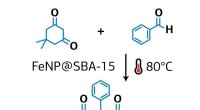 Kemiker foreslår en ny metode til grøn syntese af xanthenderivaterKredit:RUDN University En RUDN -kemiker har foreslået en ny metode til syntese af xanthenderivater, som bruges som grundlag for fremstilling af lægemidler - fra antidepressiva til antivirale og an
Kemiker foreslår en ny metode til grøn syntese af xanthenderivaterKredit:RUDN University En RUDN -kemiker har foreslået en ny metode til syntese af xanthenderivater, som bruges som grundlag for fremstilling af lægemidler - fra antidepressiva til antivirale og an -
 Forskere undersøger makrocykliske peptider som nye lægemiddelskabelonerNogle af disse molekyler kan krydse cellemembranen og kan åbne døre for nye lægemidler til i øjeblikket ubehandlede sygdomme. Kredit:Gwangju Institute of Science and Technology Takket være vores f
Forskere undersøger makrocykliske peptider som nye lægemiddelskabelonerNogle af disse molekyler kan krydse cellemembranen og kan åbne døre for nye lægemidler til i øjeblikket ubehandlede sygdomme. Kredit:Gwangju Institute of Science and Technology Takket være vores f
- DNA -sukker karakteriseret i en hidtil uset opløsning, atom for atom
- Bevis dinosaur gik på alle fire som ung og skiftede til tobenet som voksen
- Stiller ind på morgendagens LCD-skærme:Udforsk den nye IGZO-11-halvleder
- Hvordan bestemmes terrorniveauet?
- Sidste års bedste – De bedste Phys.org-artikler i 2018
- Kunne brødfrugt være den næste superfood?


