Hvilken slags reaktioner deltager ilt?
1. Forbrændingsreaktioner:Ilt er essentielt for forbrændingsreaktioner, som involverer hurtig oxidation af et brændstof, der frigiver energi i form af varme og lys. For eksempel, når vi brænder træ eller benzin, reagerer oxygen med brændstoffets komponenter (f.eks. cellulose, kulbrinter) for at producere kuldioxid (CO2), vanddamp (H2O) og energi.
2. Oxidationsreaktioner:Oxygen gennemgår let oxidations-reduktion (redox) reaktioner, hvor det fungerer som et oxidationsmiddel (elektronacceptor). Rustning af jern er et almindeligt eksempel på oxidation. Når jern kommer i kontakt med ilt og fugt, mister jernatomerne elektroner til ilt, danner jernoxid (rust) og frigiver energi.
3. Respiration:Ilt spiller en grundlæggende rolle i cellulær respiration, en afgørende proces, der genererer energi i celler. Hos både planter og dyr bruges ilt til at nedbryde glukose og andre organiske molekyler til at producere ATP (adenosintrifosfat), cellernes universelle energivaluta.
4. Biologiske reaktioner:Ilt er involveret i adskillige biokemiske reaktioner og metaboliske processer i levende organismer. For eksempel er det afgørende for nedbrydningen af kulhydrater, fedtstoffer og proteiner under fordøjelsen, hvilket giver energi og essentielle næringsstoffer til vækst og vedligeholdelse.
5. Dannelse af oxider:Ilt danner forskellige typer oxider, når det reagerer med andre grundstoffer. Disse oxider kan være basiske (f.eks. natriumoxid, Na2O), sure (f.eks. svovltrioxid, SO3) eller neutrale (f.eks. carbonmonoxid, CO).
6. Reaktion med metaller:Ilt reagerer med mange metaller og danner metaloxider. Nogle af disse reaktioner sker ved stuetemperatur (f.eks. oxidation af natrium til dannelse af natriumoxid, Na2O), mens andre kræver højere temperaturer (f.eks. oxidation af jern til dannelse af jernoxid, Fe2O3).
7. Reaktioner med ikke-metaller:Oxygen reagerer også med ikke-metalliske grundstoffer og danner oxider eller andre forbindelser. Eksempler omfatter reaktionen af oxygen med kulstof til dannelse af kuldioxid (CO2), med brint til dannelse af vand (H2O), og med svovl til dannelse af svovldioxid (SO2).
Overordnet set gør oxygens høje reaktivitet det muligt at deltage i forskellige kemiske reaktioner, der er afgørende for forbrænding, respiration, biologiske processer, industrielle anvendelser og dannelsen af en lang række forbindelser.
 Varme artikler
Varme artikler
-
 Maskinlæring sætter ind i katalysatorinteraktioner for at fremskynde materialeudviklingKredit:CC0 Public Domain En maskinlæringsteknik genopdagede hurtigt reglerne for katalysatorer, som det tog mennesker år med vanskelige beregninger at afsløre - og endda forklarede en afvigelse. U
Maskinlæring sætter ind i katalysatorinteraktioner for at fremskynde materialeudviklingKredit:CC0 Public Domain En maskinlæringsteknik genopdagede hurtigt reglerne for katalysatorer, som det tog mennesker år med vanskelige beregninger at afsløre - og endda forklarede en afvigelse. U -
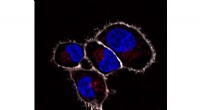 Små implantater til celler er funktionelle in vivoKunstige organeller i scavenger-cellerne hos en zebrafisk, der blev gjort synlige ved en fluorescerende reaktion. Fluorescensen opstår kun, når det indesluttede peroxidaseenzym aktiveres og reagerer m
Små implantater til celler er funktionelle in vivoKunstige organeller i scavenger-cellerne hos en zebrafisk, der blev gjort synlige ved en fluorescerende reaktion. Fluorescensen opstår kun, når det indesluttede peroxidaseenzym aktiveres og reagerer m -
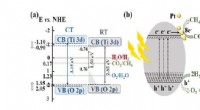 Ny fotokatalysator fremskynder omdannelsen af kuldioxid til kemiske ressourcerEt skematisk diagram, der viser mekanismen for omdannelsen af kuldioxid til metan ved hjælp af det reducerede titaniumdioxid udviklet af holdet. Kredit:DGIST Kuldioxid er en væsentlig årsag til
Ny fotokatalysator fremskynder omdannelsen af kuldioxid til kemiske ressourcerEt skematisk diagram, der viser mekanismen for omdannelsen af kuldioxid til metan ved hjælp af det reducerede titaniumdioxid udviklet af holdet. Kredit:DGIST Kuldioxid er en væsentlig årsag til -
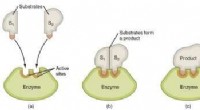 Ændring af perspektivet på oprindelsen af enzymatisk katalytisk kraftGrafisk fremstilling af trinene i en enzymatisk reaktion. Kredit:Wikimedia Commons De enzymer, der findes i levende organismer, har en imponerende katalytisk kraft. Takket være enzymer sker de kemi
Ændring af perspektivet på oprindelsen af enzymatisk katalytisk kraftGrafisk fremstilling af trinene i en enzymatisk reaktion. Kredit:Wikimedia Commons De enzymer, der findes i levende organismer, har en imponerende katalytisk kraft. Takket være enzymer sker de kemi
- Tilsluttede skovnetværk på oliepalmeplantager er nøglen til beskyttelse af truede arter
- Hvordan det ældste bevis på bevægelse kan ændre det, vi ved om livet på Jorden
- Hvilket metal ruster ikke i vand?
- Hubbles kosmiske bobler
- Bøjning af en organisk halvleder kan øge elektrisk strøm
- Fem karakteristika ved et mineral


