Hvad skulle være sværere at skille en natriumion fra klorid eller kaliumion?
$$F=k\frac{q_1q_2}{r^2}$$
hvor \(F\) er kraften, \(k\) er Coulombs konstant \((8,98\times10^9\text{ N}\cdot\text{m}^2/\text{C}^2)\ ), \(q_1\) og \(q_2\) er ladningernes størrelse, og \(r\) er afstanden mellem ladningerne.
Natrium og kalium danner begge +1 ion, så \(q_1\) er det samme for begge. Chloridion bærer -1 ladning, så \(q_2\) er også den samme. Forskellen skyldes kun afstanden \(r\). Den ioniske radius af \(Na^+\) og \(K^+\) er henholdsvis \(0,97 \AA\) og \(1,33\AA\). Da radius af \(K^+\) ion er større, er afstanden mellem \(K^+\) og \(Cl^-\) længere end afstanden mellem \(Na^+\) og \(Cl ^-\).
Ifølge Coulombs lov er kraften mellem to ladninger omvendt proportional med kvadratet på afstanden mellem dem. Derfor forventes en stærkere tiltrækningskraft mellem \(Na^+\) og \(Cl^-\) ioner.
Derfor burde det være vanskeligere at skille en natriumion fra chloridion end en kaliumion fra chloridion.
Sidste artikelHvad er den metode, der bruges til at opsamle en gas?
Næste artikelEr en konjugeret base af hs03?
 Varme artikler
Varme artikler
-
 Forskere analyserer struktur, mekanisme for fagprotein, der stjæler elektronerRisforskere analyserer rollen som ferredoxinproteiner, der produceres, når virale fager ændrer elektronoverførsel i havets bolig, fotosyntetiske bakterier, der producerer ilt og lagrer kulstof. Når vi
Forskere analyserer struktur, mekanisme for fagprotein, der stjæler elektronerRisforskere analyserer rollen som ferredoxinproteiner, der produceres, når virale fager ændrer elektronoverførsel i havets bolig, fotosyntetiske bakterier, der producerer ilt og lagrer kulstof. Når vi -
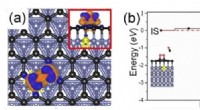 Højtydende grafenbaserede katalysatorerFigur viser (a) ladningsoverførsel mellem det understøttede grafen og det adsorberede O2 -molekyle, når substratet er dopet med en urenhed (i dette eksempel, et metalelement, farvekodet i gult). Blå (
Højtydende grafenbaserede katalysatorerFigur viser (a) ladningsoverførsel mellem det understøttede grafen og det adsorberede O2 -molekyle, når substratet er dopet med en urenhed (i dette eksempel, et metalelement, farvekodet i gult). Blå ( -
 Tilpasning af partikelstørrelserne af Pt₅Ce-legering nanopartikler til oxygenreduktionsreaktionenIfølge forskellige mekanismer for partikelvæksten er synteseprocessen opdelt i tre sekventielle perioder, nemlig periode 1, hvor Pt4+ ioner reduceres til Pt-nanopartikler; Periode 2, hvor Pt-nanoparti
Tilpasning af partikelstørrelserne af Pt₅Ce-legering nanopartikler til oxygenreduktionsreaktionenIfølge forskellige mekanismer for partikelvæksten er synteseprocessen opdelt i tre sekventielle perioder, nemlig periode 1, hvor Pt4+ ioner reduceres til Pt-nanopartikler; Periode 2, hvor Pt-nanoparti -
 Udstiller moderne falsknereRobert Trotter smedede Sarah Honns billede af 1866 først i anden halvdel af det 20. århundrede. Kredit:James Hamm, Buffalo State College, State University of New York, Bøffel, NY Kunstmarkedet boo
Udstiller moderne falsknereRobert Trotter smedede Sarah Honns billede af 1866 først i anden halvdel af det 20. århundrede. Kredit:James Hamm, Buffalo State College, State University of New York, Bøffel, NY Kunstmarkedet boo
- Hvordan byer trækker varmen
- Ny analytisk teknik hjælper forskere med at se subtile forskelle i subcellulær kemi
- Hvorfor kruser fugt mit hår?
- En ny pipeline til opdagelse af anomalier til astronomiske opdagelses- og anbefalingssystemer
- Forskeres gennembrud inden for termisk transport kunne muliggøre nye kølestrategier
- Måner Tycho krater afsløret i indviklede detaljer


