Gassers og væskers reaktioner på tryk?
Gasser:
1. Kompressibilitet: Gasser er meget komprimerbare, hvilket betyder, at deres volumen kan falde betydeligt, når der påføres tryk. Efterhånden som trykket stiger, bevæger gaspartikler sig tættere på hinanden, hvilket reducerer det samlede volumen optaget af gassen.
2. Boyles lov: Boyles lov siger, at ved en konstant temperatur er volumenet af en gas omvendt proportional med dens tryk. I enklere vendinger, når trykket stiger, falder volumenet af en gas, og omvendt.
3. Tryk-volumenforhold: Forholdet mellem tryk og volumen i gasser kan matematisk udtrykkes som P1V1 =P2V2, hvor P1 og V1 repræsenterer det indledende tryk og volumen, mens P2 og V2 repræsenterer det endelige tryk og volumen.
Væsker:
1. Ukomprimerbarhed: Væsker er næsten ukomprimerbare, hvilket betyder, at deres volumen forbliver relativt konstant selv under betydelige trykændringer. Dette skyldes, at flydende partikler allerede er tæt pakket, hvilket giver lidt plads til yderligere komprimering.
2. Pascals lov: Pascals lov siger, at tryk påført en indesluttet væske overføres ligeligt og uformindsket gennem hele væsken. I det væsentlige, når tryk påføres en væske, bliver det transmitteret jævnt til hvert punkt i væsken.
3. Tryk-volumenforhold: Forholdet mellem tryk og volumen i væsker er anderledes end for gasser. Væsker udviser meget små ændringer i volumen med trykændringer. Forholdet mellem tryk og volumen i væsker kan udtrykkes matematisk som ΔV/V₀ =-κΔP, hvor ΔV repræsenterer ændringen i volumen, V₀ er startvolumenet, κ er komprimerbarhedskoefficienten (som er meget lille for væsker), og ΔP repræsenterer ændringen i tryk.
Sammenfattende er gasser meget komprimerbare og følger Boyles lov, mens væsker er næsten inkompressible og følger Pascals lov. Forskellene i deres reaktioner på tryk skyldes arten af deres molekylære strukturer og intermolekylære kræfter.
Sidste artikelPåvirker trykændringer opløseligheden af faste stoffer?
Næste artikelHvorfor er nogle metaller reaktive?
 Varme artikler
Varme artikler
-
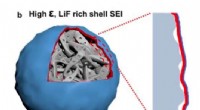 Et nyt elektrolytdesign, der kunne forbedre ydeevnen af Li-ion-batterierBillede, der viser en Si-partikel dækket af den LiF-rige SEI. Kredit:Chen et al. De fleste eksisterende lithium-ion-batterier (LIBer) integrerer grafitanoder, som har en kapacitet på cirka 350 mil
Et nyt elektrolytdesign, der kunne forbedre ydeevnen af Li-ion-batterierBillede, der viser en Si-partikel dækket af den LiF-rige SEI. Kredit:Chen et al. De fleste eksisterende lithium-ion-batterier (LIBer) integrerer grafitanoder, som har en kapacitet på cirka 350 mil -
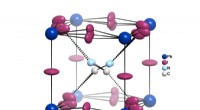 Perovskite solceller:Mulige aspekter af høj effektivitet afdækketTegningen illustrerer vekselvirkningen af den organiske methylammoniumkation (CH3NH3+) med de omgivende iodidioner. Skiftet af iodidatomerne ud af det fælles plan med bly forårsager brud på inversio
Perovskite solceller:Mulige aspekter af høj effektivitet afdækketTegningen illustrerer vekselvirkningen af den organiske methylammoniumkation (CH3NH3+) med de omgivende iodidioner. Skiftet af iodidatomerne ud af det fælles plan med bly forårsager brud på inversio -
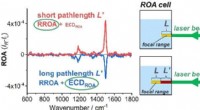 Interferens fører til unøjagtig Raman-spektroskopisk analyse af vitamin B12Kredit:Wiley Mange naturlige produkter er komplicerede organiske molekyler. På trods af denne kompleksitet, videnskabsmænd er normalt i stand til at undersøge dem ved hjælp af spektroskopiske tekn
Interferens fører til unøjagtig Raman-spektroskopisk analyse af vitamin B12Kredit:Wiley Mange naturlige produkter er komplicerede organiske molekyler. På trods af denne kompleksitet, videnskabsmænd er normalt i stand til at undersøge dem ved hjælp af spektroskopiske tekn -
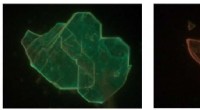 Kamæleonmaterialer:Oprindelsen af farvevariation i lavdimensionelle perovskitterBredfeltsfotoluminescensmikrofotografier (230_175 μm) viser, hvordan nogle Perovskite-flager ser lysegrønne ud over hele deres område (venstre panel), mens andre flager udviser en tydeligt rødforskudt
Kamæleonmaterialer:Oprindelsen af farvevariation i lavdimensionelle perovskitterBredfeltsfotoluminescensmikrofotografier (230_175 μm) viser, hvordan nogle Perovskite-flager ser lysegrønne ud over hele deres område (venstre panel), mens andre flager udviser en tydeligt rødforskudt
- Sort hul eller intet sort hul:Om resultatet af neutronstjernekollisioner
- Studiet undersøger, hvordan farvefællesskaber forbliver udelukket fra alt det, naturen har at tilb…
- Brug af big data til at bekæmpe katastrofer
- Forskere tilbageviser 20 år gamle antagelser i solcelleproduktion
- Hurtige fakta om Rubber
- Vil du have lidt is med din exoplanet? For jordlignende verdener kan det være en stor opgave


