Hvorfor er nogle metaller reaktive?
Her er nogle nøglefaktorer, der bidrager til metallers reaktivitet:
1. Valenselektronkonfiguration:Metaller med lav ioniseringsenergi har normalt en eller to valenselektroner i deres yderste skal. Disse elektroner er løst bundet til kernen, hvilket gør dem lettere at fjerne og modtagelige for kemiske reaktioner. For eksempel har alkalimetaller (Gruppe 1) en enkelt valenselektron, mens jordalkalimetaller (Gruppe 2) har to valenselektroner, og de er kendt for at være meget reaktive.
2. Atomstørrelse:Størrelsen af metalatomer spiller også en rolle i reaktiviteten. Generelt, når du bevæger dig ned i en gruppe (søjle) i det periodiske system, øges atomstørrelsen. Dette skyldes, at antallet af elektronskaller stiger, hvilket fører til en større afstand mellem de yderste elektroner og den positivt ladede kerne. Større atomer har en svagere tiltrækning mellem kernen og valenselektronerne, hvilket gør dem mere tilbøjelige til at gå tabt under kemiske reaktioner. For eksempel er cæsium (Cs) mere reaktivt end natrium (Na) på grund af dets større atomare størrelse.
3. Ioniseringsenergi:Ioniseringsenergi er den energi, der kræves for at fjerne den yderste elektron fra et atom. Metaller med en lavere ioniseringsenergi har en svagere tiltrækning mellem kernen og valenselektronerne. Derfor kan de lettere opgive elektroner, hvilket gør dem mere reaktive. For eksempel har kalium (K) en lavere ioniseringsenergi end calcium (Ca), så kalium er mere reaktivt.
4. Hydrationsenergi:Hydrationsenergi refererer til den energi, der frigives, når ioner opløses i vand og bliver omgivet af vandmolekyler. Metaller, der danner stabile hydratiserede ioner, har højere hydreringsenergier. Denne energi kompenserer for den energi, der kræves for at fjerne elektroner (ioniseringsenergi), hvilket gør den samlede reaktion mere gunstig. Metaller med høj hydreringsenergi har en tendens til at være mere reaktive. For eksempel har magnesium (Mg) en højere hydreringsenergi end aluminium (Al), hvilket bidrager til dets højere reaktivitet.
5. Reduktionspotentiale:Et metals reduktionspotentiale er et mål for dets tendens til at gennemgå reduktion, hvilket involverer at få elektroner. Metaller med et mere negativt reduktionspotentiale er mere tilbøjelige til at blive reduceret og derfor mere reaktive. For eksempel har zink (Zn) et mere negativt reduktionspotentiale end jern (Fe), hvilket indikerer, at zink er mere reaktivt.
Sammenfattende er reaktiviteten af metaller påvirket af faktorer som valenselektronkonfiguration, atomstørrelse, ioniseringsenergi, hydreringsenergi og reduktionspotentiale. Metaller med løst fastholdte valenselektroner, større atomstørrelser, lave ioniseringsenergier og høje hydreringsenergier har en tendens til at være mere reaktive. At forstå disse faktorer hjælper os med at forudsige metallers reaktivitet og deres adfærd i kemiske reaktioner.
Sidste artikelGassers og væskers reaktioner på tryk?
Næste artikelHvor mange mol NF er opløst i 4 L en opløsning, der har koncentrationen M?
 Varme artikler
Varme artikler
-
 Søger efter egenskaberne ved prisvindende vinKredit:WSU Prisvindende vine har en tendens til at være mere komplekse, og de bedste har høje ethanol- og sukkerniveauer. Det er konstateringen af et nyligt papir i Journal of Wine Research f
Søger efter egenskaberne ved prisvindende vinKredit:WSU Prisvindende vine har en tendens til at være mere komplekse, og de bedste har høje ethanol- og sukkerniveauer. Det er konstateringen af et nyligt papir i Journal of Wine Research f -
 Meget effektiv enkeltatom-katalysator kan hjælpe bilindustrienSingle-atom platin (blå kugle) belagt guld (gul kugle) nanopartikler kan tjene som en yderst effektiv katalysator for en brændselscelle kemisk reaktion (dvs. myresyreoxidation). Kredit:Canadian Light
Meget effektiv enkeltatom-katalysator kan hjælpe bilindustrienSingle-atom platin (blå kugle) belagt guld (gul kugle) nanopartikler kan tjene som en yderst effektiv katalysator for en brændselscelle kemisk reaktion (dvs. myresyreoxidation). Kredit:Canadian Light -
 Et skridt nærmere biotekniske erstatninger for skibe og kanalerKredit:CC0 Public Domain Et team af forskere fra Brigham og Womens Hospital har udviklet en måde at bioprinte rørformede strukturer på, der bedre efterligner oprindelige kar og kanaler i kroppen.
Et skridt nærmere biotekniske erstatninger for skibe og kanalerKredit:CC0 Public Domain Et team af forskere fra Brigham og Womens Hospital har udviklet en måde at bioprinte rørformede strukturer på, der bedre efterligner oprindelige kar og kanaler i kroppen. -
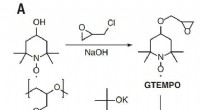 Forskere viser den højeste rapporterede ledningsevne for organisk radikal polymerDen monomersyntese og ringåbningspolymerisationsbaserede syntetiske skema, der bruges til at generere PTEO-radikalpolymeren. Kredit: Videnskab (2018). DOI:10.1126/science.aao7287 Et team af forsk
Forskere viser den højeste rapporterede ledningsevne for organisk radikal polymerDen monomersyntese og ringåbningspolymerisationsbaserede syntetiske skema, der bruges til at generere PTEO-radikalpolymeren. Kredit: Videnskab (2018). DOI:10.1126/science.aao7287 Et team af forsk
- Kalkunbryst med lavere natrium vinder sensorisk test over fuld-salt mulighed
- One night brand:Sexede snaps fører til rene køb
- Volvo tilbagekalder biler til at reparere automatisk bremsefejl
- Et opvarmende klima og intensiveret arealanvendelse øger kviksølvindholdet i fisk
- Sådan måles korn i runde bins
- Ny undersøgelse af et nyligt opdaget klorofylmolekyle kan være nøglen til bedre solceller


