64,3 gram opløst stof i 3,90 X 10Ë vand hæver kogepunktet til 100,680 àC?
$$\Delta T_b =K_b \ gange m$$
hvor ΔTb er ændringen i kogepunktet, Kb er opløsningsmidlets kogepunktshøjdekonstant, og m er opløsningens molalitet.
Vi får givet, at ΔTb =100.680 °C - 100.000 °C =0.680 °C, og at opløsningsmidlet er vand, som har en kogepunktshøjdekonstant på Kb =0,512 °C/m.
Ved at indsætte disse værdier i ligningen får vi:
$$0,680 °C =0,512 °C/m \ gange m$$
Løser vi for m, får vi:
$$m =1,33 m$$
Det betyder, at opløsningen indeholder 1,33 mol opløst stof pr. kg vand.
For at beregne molmassen af det opløste stof kan vi bruge følgende ligning:
$$Molarity =\frac{Moles\text{ of Solute}}{Liters\text{ of Solution}}$$
Vi ved, at opløsningen indeholder 1,33 mol opløst stof, og vi kan beregne liter opløsning ved hjælp af densiteten af vand (1 g/mL):
$$Liters\text{ of Solution} =\frac{3,90 \times 10^{2} g}{1 g/mL} =390 mL$$
Nu kan vi bruge molær masseformlen:
$$Molaritet =\frac{1.33\text{ mol}}{0.390 \text{ L}}$$
Molaritet bliver:
$$Molaritet =3,41$$
Til sidst bruger vi følgende ligning til at beregne molmassen af det opløste stof:
$$Molar\text{ Mass} =\frac{Grams\text{ of Solute}}{Moles\text{ of Solute}}$$
Ved at erstatte de værdier, vi kender, får vi:
$$Molar\text{ Mass} =\frac{64,3 g}{1,33 mol}$$
$$Molar\text{ Mass} =48,3\text{ g/mol}$$
Derfor er molmassen af det opløste stof 48,3 g/mol.
Sidste artikelHar arsenpentaiodid et metal?
Næste artikelHvorfor gruppe 17 grundstoffer er stærke ikke-metaller, mens 1-metaller?
 Varme artikler
Varme artikler
-
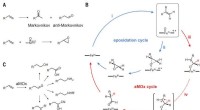 Modificeret enzym bruges til at give bedre anti-Markovnikov-selektivitet i alkenoxidationerAnti-Markovnikov oxidation af alkener. Kredit:(c) Videnskab (2017). DOI:10.1126/science.aao1482 (Phys.org) – Et team af forskere ved California Institute of Technology har brugt et modificeret e
Modificeret enzym bruges til at give bedre anti-Markovnikov-selektivitet i alkenoxidationerAnti-Markovnikov oxidation af alkener. Kredit:(c) Videnskab (2017). DOI:10.1126/science.aao1482 (Phys.org) – Et team af forskere ved California Institute of Technology har brugt et modificeret e -
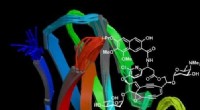 Forskere er verdens første til at reproducere en komplet kopi af anti-tumor-antibiotikumBillede der viser kromoproteinet på Kedarcidin, et komplekst anti-tumor-antibiotikum, som forskerne har reproduceret syntetisk i laboratoriet for første gang. Kredit:Professor Martin Lear, University
Forskere er verdens første til at reproducere en komplet kopi af anti-tumor-antibiotikumBillede der viser kromoproteinet på Kedarcidin, et komplekst anti-tumor-antibiotikum, som forskerne har reproduceret syntetisk i laboratoriet for første gang. Kredit:Professor Martin Lear, University -
 At fange atomer i aktion:se næste generations materialer krystallisereEn af de mange mulige ruter til næste generations materialer-dem, der muliggør nye fremskridt inden for datalagring, elektroniske anordninger, og lettere og stærkere strukturelle byggematerialer - er
At fange atomer i aktion:se næste generations materialer krystallisereEn af de mange mulige ruter til næste generations materialer-dem, der muliggør nye fremskridt inden for datalagring, elektroniske anordninger, og lettere og stærkere strukturelle byggematerialer - er -
 Nyt kompositmateriale har potentiale til medicinsk brugProfessor Gajanan Bhat holder et elastisk nonwoven-materiale. Kredit:Andrew Davis Tucker/UGA Forskere fra University of Georgia har udviklet et nyt materiale med egenskaber, der er ideelle til med
Nyt kompositmateriale har potentiale til medicinsk brugProfessor Gajanan Bhat holder et elastisk nonwoven-materiale. Kredit:Andrew Davis Tucker/UGA Forskere fra University of Georgia har udviklet et nyt materiale med egenskaber, der er ideelle til med
- Hvad betyder OD i videnskab?
- Sådan smeltes en Palladium Bullion
- Skjulte omkostninger – hvordan infrastrukturudvikling kan sætte skub i ulovlig handel med vilde dyr
- Ny teknik gør det lettere at bestemme, hvordan menneskelige forfædre brugte ild
- Ny økonomisk model kan forhindre problemer med kapitalstrømmen
- Fire års beregninger fører til ny indsigt i muon -anomali


