Hvis du skal have temperaturen til -10,0 grader Celsius, hvor mange gram NaCl skal der tilsættes 3,5 kg vand nå denne temperatur?
$$\Delta T_f =K_f * m$$
hvor \(\Delta T_f\) er frysepunktssænkningen, \(K_f\) er frysepunktets sænkningskonstant for opløsningsmidlet (\(K_f =1,86 °C/m\) for vand), og \(m\) er opløsningens molalitet.
Omarrangerer for at løse for \(m\):
$$m =\frac{\Delta T_f}{K_f}$$
Først skal vi beregne frysepunktssænkningen:
$$\Delta T_f =-10,0 °C - 0,0 °C (vandets begyndelsestemperatur er 0 °C) =-10,0 °C $$
Nu kan vi beregne molaliteten:
$$m =\frac{-10,0 °C}{1,86 °C/m} =-5,38 m$$
For at finde de nødvendige gram NaCl skal vi bruge formlen, der relaterer molalitet til antallet af mol og massen af opløst stof:
$$m =\frac{mol\ af\ NaCl}{kg\ af\ opløsningsmiddel}$$
Omarrangering for at løse for mol NaCl:
$$mol \ af \ NaCl =m * kg\ af\ opløsningsmiddel$$
Konvertering af gram til kilogram:
$$mol \ af \ NaCl=(-5,38\ m) * 3,5 kg =-18,83\ mol \ af \ NaCl $$
Til sidst konverterer mol til gram:
$$-18,83\ mol \ af \ NaCl * (58,44 g/mol) =\boxed{-1100\ g \ NaCl }$$
(da molekylmassen af NaCl er 58,44 g/mol)
Derfor skal -1100 g NaCl tilsættes til 3,5 kg (3500) gram vand for at nå en temperatur på -10,0°C.
 Varme artikler
Varme artikler
-
 Optimering af brugen af rengøringsteknologierPlacering af fuld kegle dyser i et CAD miljø. Kredit:Fraunhofer-Gesellschaft Vi kender det fra vores eget hjem:omfangsrige køkkenredskaber og hvidevarer er svære at rengøre. I industrien, kompleks
Optimering af brugen af rengøringsteknologierPlacering af fuld kegle dyser i et CAD miljø. Kredit:Fraunhofer-Gesellschaft Vi kender det fra vores eget hjem:omfangsrige køkkenredskaber og hvidevarer er svære at rengøre. I industrien, kompleks -
 Lys forbrænder med nye syrerLysbestråling på den omgivende inerte nye PLAG genererer Lewis Acid som en alsidig katalysator. Som billedet viser, er denne proces som at vende et kortspil og altid komme med det helt mægtige kort. K
Lys forbrænder med nye syrerLysbestråling på den omgivende inerte nye PLAG genererer Lewis Acid som en alsidig katalysator. Som billedet viser, er denne proces som at vende et kortspil og altid komme med det helt mægtige kort. K -
 Sneeze cam afslører de bedste stofkombinationer til stofmaskerKredit:Pixabay/CC0 Public Domain Under COVID-19-pandemien, Stof ansigtsmasker blev en måde at hjælpe med at beskytte dig selv og andre mod virussen. Og for nogle mennesker, de blev et fashion stat
Sneeze cam afslører de bedste stofkombinationer til stofmaskerKredit:Pixabay/CC0 Public Domain Under COVID-19-pandemien, Stof ansigtsmasker blev en måde at hjælpe med at beskytte dig selv og andre mod virussen. Og for nogle mennesker, de blev et fashion stat -
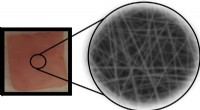 Implanterbar piezoelektrisk polymer forbedrer kontrolleret frigivelse af lægemidlerEn implanterbar piezoelektrisk polymer nanofiber -enhed, der frigiver kontrollerede mængder af et lægemiddel under mekanisk kraft. Kredit:Jin Nam/UCR En membran lavet af tråde af en polymer, der a
Implanterbar piezoelektrisk polymer forbedrer kontrolleret frigivelse af lægemidlerEn implanterbar piezoelektrisk polymer nanofiber -enhed, der frigiver kontrollerede mængder af et lægemiddel under mekanisk kraft. Kredit:Jin Nam/UCR En membran lavet af tråde af en polymer, der a
- Observation af faseovergangen af flydende krystaldefekter for første gang
- Hvordan påvirker reduktion af gasvolumen trykket af en gas?
- Forbedring af vandkvaliteten ved Lake Eries
- Forskere studerer kompleks morfologi af den protoplanetariske skive omkring stjernen MWC 758
- Hvor er Mars' måne Deimos?
- Grafen møder hedebølger


