Implanterbar piezoelektrisk polymer forbedrer kontrolleret frigivelse af lægemidler
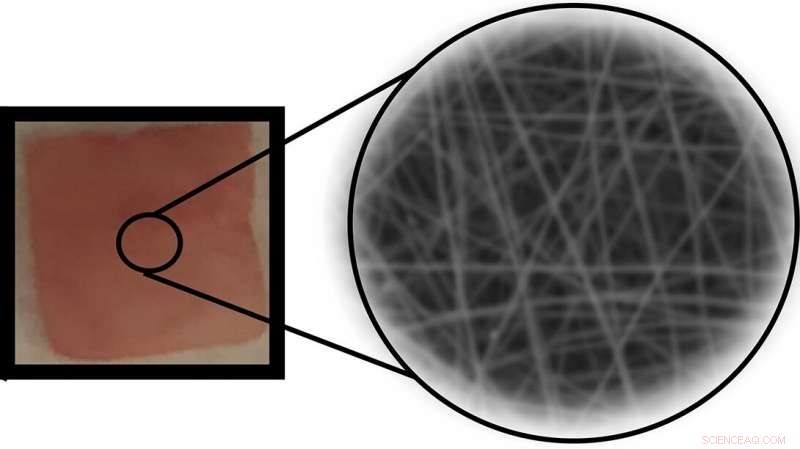
En implanterbar piezoelektrisk polymer nanofiber -enhed, der frigiver kontrollerede mængder af et lægemiddel under mekanisk kraft. Kredit:Jin Nam/UCR
En membran lavet af tråde af en polymer, der almindeligvis anvendes i vaskulære suturer, kan fyldes med terapeutiske lægemidler og implanteres i kroppen, hvor mekaniske kræfter aktiverer polymerens elektriske potentiale og langsomt frigiver stofferne.
Det nye system, udviklet af en gruppe ledet af bioingeniører ved UC Riverside og udgivet i ACS Applied Bio Materials , overvinder de største begrænsninger ved konventionel lægemiddeladministration og nogle metoder til kontrolleret frigivelse, og kunne forbedre behandlingen af kræft og andre kroniske sygdomme.
Ulemperne ved konventionel lægemiddeladministration omfatter gentagen administration, uspecifik biodistribution i kroppens systemer, lægemiddelmolekylers langsigtede uholdbarhed, og høj cytotoksicitet, udgør en udfordring for effektiv behandling af kroniske sygdomme, der kræver forskellige lægemiddeldoser over tid for optimal terapeutisk effekt. De fleste metoder til kontrolleret frigivelse indkapsler lægemiddelpartikler i bionedbrydeligt, boblelignende beholdere, der opløses over tid for at frigive stoffet, gør det vanskeligt at levere stoffer efter en tidsplan. Andre involverer en batteridrevet enhed, der ikke er biokompatibel.
Jin Nam, en lektor i bioteknik ved UC Riversides Marlan and Rosemary Bourns College of Engineering, driver et laboratorium, der arbejder med biokompatible polymerer til at bygge rammer kendt som stilladser, der hjælper stamceller med at reparere væv og organer. En af disse polymerer, poly(vinylidenfluorid-trifluor-ethylen), eller P(VDF-TrFE), kan producere en elektrisk ladning under mekanisk belastning. Nam indså denne ejendom, kendt som piezoelektricitet, gjort polymeren til en potentielt levedygtig kandidat til et lægemiddelfrigivelsessystem.
Hans team brugte en teknik kaldet elektrospinning til at producere P(VDF-TrFE) nanofibre lagdelt i en tynd måtte. Strukturering af materialet i nanoskala ved elektrospinning optimerede følsomheden af de resulterende nanofibre, så lægemiddelleveringssystemet ville reagere på fysiologisk sikre kraftstørrelser, mens det forblev ufølsomt over for daglige aktiviteter. Nanofibrernes store overfladeareal tillod dem at adsorbere en relativt stor mængde lægemiddelmolekyler.
Efter indlejring af filmen i en hydrogel, der efterligner levende væv, en række tests med terapeutiske chokbølger genererede tilstrækkelig elektrisk ladning til at frigive et elektrostatisk fastgjort model -lægemiddelmolekyle i den omgivende gel. Forskerne kunne justere mængden af lægemiddelfrigivelse ved at variere det påførte tryk og varighed.
"Dette piezoelektriske nanofiberbaserede lægemiddelleveringssystem muliggør lokal levering af lægemiddelmolekyler efter behov, som ville være nyttig til sygdomme eller tilstande, der kræver langvarig gentagen lægemiddeladministration, såsom kræftbehandlinger, " sagde Nam. "Det store forhold mellem overfladeareal og volumen af nanofibrøs struktur muliggør en større lægemiddelbelastning, fører til en enkelt injektion eller implantation, der varer længere end konventionel lægemiddellevering."
Sammenlignet med traditionelle lægemiddelleveringssystemer baseret på nedbrydning eller diffusionsfrigivelse, der typisk viser en indledende burst -frigivelse efterfulgt af forskellige frigivelseshastigheder, den lineære profil af lægemiddelfrigivelse fra det piezoelektriske system muliggør præcis administration af lægemiddelmolekyler uanset implantationens varighed. Gentagne lægemiddelfrigivelsestest efter behov viste en tilsvarende mængde lægemiddelfrigivelse pr. Aktivering, bekræfter den robuste kontrol af frigivelseshastigheden.
Følsomheden af lægemiddelfrigivelseskinetikken kan indstilles ved at kontrollere nanofiberstørrelsen til et område, der aktiveres af terapeutiske chokbølger, bruges ofte til behandling af muskel- og skeletsmerter med et håndholdt apparat. Mindre, mere følsomme nanofiberstørrelser kan bruges til implantation i dybe væv, såsom nær en knogle under muskler, mens mindre følsomme større nanofibre kunne finde anvendelse i subkutane applikationer for at undgå falsk aktivering ved utilsigtet påvirkning.
 Varme artikler
Varme artikler
-
 Forskere bruger lydbølger til at forhindre små kemiske reaktorer i at tilstoppeProfessor Simon Kuhn. Kredit:KU Leuven - Rob Stevens Virksomheder er ivrige efter at bruge miniaturekemiske reaktorer til fremstilling af lægemidler og finkemikalier, men er modløse af deres tende
Forskere bruger lydbølger til at forhindre små kemiske reaktorer i at tilstoppeProfessor Simon Kuhn. Kredit:KU Leuven - Rob Stevens Virksomheder er ivrige efter at bruge miniaturekemiske reaktorer til fremstilling af lægemidler og finkemikalier, men er modløse af deres tende -
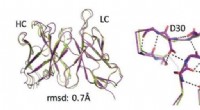 Principper for beregningsmæssigt design af bindende antistofferComputerdesign (limegrøn) sammenlignes med eksperimentelle strukturer (lilla) på atomniveau, afslører atomnøjagtighed i overordnet struktur (venstre) og i sløjfeområder (højre). Kredit:Weizmann Instit
Principper for beregningsmæssigt design af bindende antistofferComputerdesign (limegrøn) sammenlignes med eksperimentelle strukturer (lilla) på atomniveau, afslører atomnøjagtighed i overordnet struktur (venstre) og i sløjfeområder (højre). Kredit:Weizmann Instit -
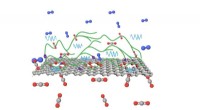 Næste generations membraner til kulstoffangstCO2-selektive polymere kæder forankret på grafen trækker effektivt CO2 fra en røggasblanding. Kredit:KV Agrawal (EPFL) CO 2 fremstillet ved afbrænding af fossile brændstoffer frigives stadig for
Næste generations membraner til kulstoffangstCO2-selektive polymere kæder forankret på grafen trækker effektivt CO2 fra en røggasblanding. Kredit:KV Agrawal (EPFL) CO 2 fremstillet ved afbrænding af fossile brændstoffer frigives stadig for -
 Forskere opdager, at molekyler spin flip fra magnetiske til ikke-magnetiske former dynamiskKredit:University of Missouri-Columbia En uventet opdagelse i professor Arthur Suits kemilaboratorium kunne få konsekvenser for fremstilling af mere effektive solceller og forbedring af fotodynami
Forskere opdager, at molekyler spin flip fra magnetiske til ikke-magnetiske former dynamiskKredit:University of Missouri-Columbia En uventet opdagelse i professor Arthur Suits kemilaboratorium kunne få konsekvenser for fremstilling af mere effektive solceller og forbedring af fotodynami
- AAA:Koldt vejr kan skære elbilernes rækkevidde med over 40 procent
- Tørkeramte Jordan for at bygge afsaltningsanlæg fra Rødehavet
- Miljøvenlige alsidige nanokapsler udviklet
- Betyder marketingfolk noget for iværksættere?
- Indkapslede NiCo -legering nanopartikler, der katalyserer HDO -reaktioner
- Ny NASA-mission for at opdage brug af plantevand fra rummet


