Hvad er oxidationstallet for oxygen og hvordan?
Her er nogle almindelige scenarier og undtagelser vedrørende iltets oxidationsnummer:
1. I Oxider:I binære forbindelser dannet mellem oxygen og et metal, såsom metaloxider, er oxidationstallet for oxygen normalt -2. For eksempel i magnesiumoxid (MgO) er oxidationstallet for oxygen -2, mens magnesium har et oxidationstal på +2.
2. Peroxider og superoxider:I peroxider, såsom hydrogenperoxid (H2O2), er oxidationstallet for oxygen -1. Dette skyldes, at oxygen-iltbindingen i peroxider indeholder en enkeltbinding og et enkelt elektronpar, der er delt mellem de to oxygenatomer. I superoxider, som kaliumsuperoxid (KO2), er oxidationstallet for oxygen -1/2. Dette skyldes tilstedeværelsen af en uparret elektron i oxygen-iltbindingen.
3. Iltfluorider:I oxygenfluorider, såsom oxygendifluorid (OF2), er oxygenets oxidationstal +2. Dette skyldes, at fluor er mere elektronegativt end oxygen, hvilket får oxygen til at miste to elektroner og opnå et positivt oxidationstal.
4. Forbindelser med brint:I forbindelser, hvor oxygen er bundet til brint, såsom vand (H2O), er oxidationstallet for oxygen normalt -2. Dette skyldes, at iltens elektronegativitet er højere end brint, hvilket resulterer i en delvis negativ ladning på ilt og en delvis positiv ladning på brint.
5. Organiske forbindelser:I organiske forbindelser kan oxidationstallet for oxygen variere afhængigt af den specifikke funktionelle gruppe. For eksempel i alkoholer er oxidationstallet for oxygen -1, i ethere er det -2, og i carboxylsyrer er det -1.
Det er vigtigt at bemærke, at oxidationsnummeret tildelt et atom er et formelt koncept, der bruges til at repræsentere elektronoverførslen i et molekyle. I virkeligheden er elektronfordelingen i molekyler mere kompleks og kan involvere partielle ladninger snarere end diskrete heltalsværdier.
Sidste artikelHvad sker der, når titanium blandes med ilt?
Næste artikelEr polyethylen opløseligt Hvad er opløselighed i g100ml Hvorfor?
 Varme artikler
Varme artikler
-
 Blåt pigment fra manipulerede svampe kan hjælpe med at gøre tekstilindustrien grønLederforsker Aindrila Mukhopadhyay har et hætteglas med rensede indigoidine krystaller. Kredit:Marilyn Chung/Berkeley Lab Tit, resultaterne af grundlæggende videnskabelig forskning er mange skridt
Blåt pigment fra manipulerede svampe kan hjælpe med at gøre tekstilindustrien grønLederforsker Aindrila Mukhopadhyay har et hætteglas med rensede indigoidine krystaller. Kredit:Marilyn Chung/Berkeley Lab Tit, resultaterne af grundlæggende videnskabelig forskning er mange skridt -
 Stressede kakaotræer kan producere mere smagfuld chokoladeKredit:American Chemical Society De fleste er enige om, at chokolade smager fantastisk, men er der en måde at få det til at smage endnu bedre? Måske, ifølge forskere, der kiggede på forskellige fo
Stressede kakaotræer kan producere mere smagfuld chokoladeKredit:American Chemical Society De fleste er enige om, at chokolade smager fantastisk, men er der en måde at få det til at smage endnu bedre? Måske, ifølge forskere, der kiggede på forskellige fo -
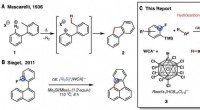 Funktionalisering af uaktiverede alkaner ved hjælp af reaktioner baseret på katalysatorer fremstil…Reaktioner, der involverer formodede phenylkationer. (A) Mascarellis reaktion (12). (B) Siegels intramolekylære Friedel-Crafts reaktion af arylfluorider (15). (C) Vores dobbelte C–F/C–H-funktionaliser
Funktionalisering af uaktiverede alkaner ved hjælp af reaktioner baseret på katalysatorer fremstil…Reaktioner, der involverer formodede phenylkationer. (A) Mascarellis reaktion (12). (B) Siegels intramolekylære Friedel-Crafts reaktion af arylfluorider (15). (C) Vores dobbelte C–F/C–H-funktionaliser -
 Fluorescerende prober giver et bedre overblik over lægemiddellevering i cellerKredit:Cornell University Udvælgelse af de mest effektive molekyler til lægemiddellevering er ofte en proces, der prøver og fejler, men Cornell-ingeniører yder en vis præcision takket være en tekn
Fluorescerende prober giver et bedre overblik over lægemiddellevering i cellerKredit:Cornell University Udvælgelse af de mest effektive molekyler til lægemiddellevering er ofte en proces, der prøver og fejler, men Cornell-ingeniører yder en vis præcision takket være en tekn
- Forskning afslører eksotiske kvantetilstande i dobbeltlagsgrafen
- Sociale medier giver forældre flere kontroller. Men hjælper de?
- Hvordan vandt Lockheed NASAs Orion -kontrakt?
- Har børn mistet et helt års skolegang og social udvikling? Det kommer an på, siger eksperter
- Højtemperatursensorteknologier for at øge kraftværkets effektivitet
- Afled egenskaberne ved en ny form for diamant


