Hvad betragtes som gunstige kemiske reaktioner?
Faktorer, der bidrager til gunstige kemiske reaktioner omfatter:
Eksotermiske reaktioner :Reaktioner, der frigiver varme, er generelt mere gunstige end endoterme reaktioner, der absorberer varme. Frigivelsen af varme indikerer et fald i systemets energi, hvilket gør produkterne mere stabile.
Øget entropi: Reaktioner, der fører til en stigning i systemets tilfældighed eller uorden, er mere gunstige. Dette kan forekomme, når der produceres gasser, faste stoffer opløses i væsker, eller komplekse molekyler nedbrydes til mere simple.
Danning af stærke bånd: Reaktioner, der resulterer i dannelsen af stærkere kemiske bindinger, er mere gunstige sammenlignet med dem, der danner svagere bindinger. Stærke bindinger mellem atomer eller molekyler fører til mere stabile produkter.
Lav aktiveringsenergi: Reaktioner, der kræver en lavere aktiveringsenergi for at starte reaktionen, er mere gunstige. Aktiveringsenergi er den mindste energi, der kræves for, at en reaktion kan opstå, og en lavere aktiveringsenergi betyder, at reaktionen kan forløbe lettere.
Overordnet set er gunstige kemiske reaktioner karakteriseret ved et fald i fri energi, eksotermicitet, øget entropi, dannelse af stærke bindinger og lav aktiveringsenergi. Disse faktorer driver tilsammen reaktionen mod afslutning og gør det mere sandsynligt, at den opstår spontant.
 Varme artikler
Varme artikler
-
 Kemikere skaber en ny vej til PHA'er:naturligt nedbrydeligt bioplastFra venstre:kandidatstuderende Andrea Westlie, professor Eugene Chen, og forsker Xiaoyan Tang i Chemistry Research Building. Kredit:John Eisele En bølge af offentlig fremdrift svulmer op mod krise
Kemikere skaber en ny vej til PHA'er:naturligt nedbrydeligt bioplastFra venstre:kandidatstuderende Andrea Westlie, professor Eugene Chen, og forsker Xiaoyan Tang i Chemistry Research Building. Kredit:John Eisele En bølge af offentlig fremdrift svulmer op mod krise -
 Nye ultra-resistente og selvreparerende betonmaterialerKredit:Universitat Politècnica de València Et team fra Universitat Politècnica de València (UPV) og Politecnico di Milano har designet nye ultra-resistente og selvreparerende betonmaterialer. De h
Nye ultra-resistente og selvreparerende betonmaterialerKredit:Universitat Politècnica de València Et team fra Universitat Politècnica de València (UPV) og Politecnico di Milano har designet nye ultra-resistente og selvreparerende betonmaterialer. De h -
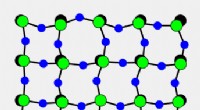 Hemmeligheden bag krystaller, der krymper ved opvarmningDenne animation viser, hvordan faste krystaller af scandiumfluorid krymper ved opvarmning. Mens bindingerne mellem scandium (grøn) og fluoratomer (blå) forbliver relativt stive, fluoratomerne langs si
Hemmeligheden bag krystaller, der krymper ved opvarmningDenne animation viser, hvordan faste krystaller af scandiumfluorid krymper ved opvarmning. Mens bindingerne mellem scandium (grøn) og fluoratomer (blå) forbliver relativt stive, fluoratomerne langs si -
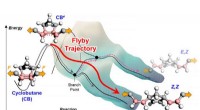 Kemiske reaktioner bryder fri fra energibarrierer ved at bruge flyby-banerEn illustration, der viser et molekyles bevægelse hen over en potentiel energioverflade på den måde, vandrere følger konturkortet over bjerge og dale langs en sti. Når der påføres en mekanisk kraft, e
Kemiske reaktioner bryder fri fra energibarrierer ved at bruge flyby-banerEn illustration, der viser et molekyles bevægelse hen over en potentiel energioverflade på den måde, vandrere følger konturkortet over bjerge og dale langs en sti. Når der påføres en mekanisk kraft, e
- Sådan fungerer forgasning
- Blyfri sjældne jordarters dobbelte perovskit nanokrystaller med nær-infrarød emission
- Arianespace og ESA annoncerer Jupiter Icy Moons Explorer opsendelseskontrakt
- Hvad er prismer og pyramider?
- Trump smækker Amazon på skatter, postaftale (Opdatering)
- Var ursuppen en solid pre-protein gryderet?


