Hvad er de ret reaktive metaller, der findes som malmforbindelser, ofte kan oxider og carbonater udvindes ved hjælp af kulstof for at reducere metalforbindelsen rent metal?
- Jern (Fe)
- Kobber (Cu)
- Zink (Zn)
- Bly (Pb)
- Tin (Sn)
malm :Malmene af disse metaller er forbindelser som oxider, carbonater og sulfider. Disse malme findes i jordskorpen.
Kulstof :Kulstof er et reduktionsmiddel, hvilket betyder, at det kan donere elektroner til andre atomer. Når kulstof opvarmes med en metalforbindelse, donerer kulstofatomerne elektroner til metalionerne, hvilket reducerer dem til rent metal.
Redox-reaktion :Den overordnede reaktion, der finder sted under denne proces, er en redoxreaktion, hvor det ene stof (kulstof) oxideres (taber elektroner), og det andet stof (metalforbindelse) reduceres (vinder elektroner).
Eksempel :For eksempel, i tilfælde af jern, kan reaktionen repræsenteres som:
Fe2O3 (jern(III)oxid) + 3C (kulstof) -> 2Fe (rent jern) + 3CO2 (kuldioxid)
Udtrækningsproces :Ekstraktionsprocessen involverer opvarmning af metalforbindelsen med kul i en ovn ved høje temperaturer. Kulstofatomerne reagerer med oxygenatomerne i metalforbindelsen og danner kuldioxidgas. Denne gas slipper ud og efterlader det rene metal.
Betydning :Denne metode til at udvinde metaller fra deres malme ved hjælp af kulstof som reduktionsmiddel har været historisk betydningsfuld og er stadig meget udbredt i forskellige industrier, såsom jern- og stålproduktion, kobbersmeltning og zinkraffinering.
Sidste artikelHvor meget zink var der i karbonatet?
Næste artikelEr vand eller salt tungere?
 Varme artikler
Varme artikler
-
 Native New Zealand-træ sætter brodden på smerteKredit:Institute for Molecular Bioscience, University of Queensland Forskere ved University of Queensland (UQ) har fundet ud af, at et indfødt newzealandsk stikkende træ producerer toksiner, der ka
Native New Zealand-træ sætter brodden på smerteKredit:Institute for Molecular Bioscience, University of Queensland Forskere ved University of Queensland (UQ) har fundet ud af, at et indfødt newzealandsk stikkende træ producerer toksiner, der ka -
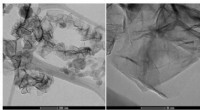 Reduktion af drivhusgasemissioner ved hjælp af mikrobølgeplasmateknologiBillederne viser nanografenmorfologien som produceret i mikrobølgeplasmaet. Nanografenet optræder her i krøllet filamentær form. Større forstørrelse viser overlappede ark og krøllede kanter. Kredit:H
Reduktion af drivhusgasemissioner ved hjælp af mikrobølgeplasmateknologiBillederne viser nanografenmorfologien som produceret i mikrobølgeplasmaet. Nanografenet optræder her i krøllet filamentær form. Større forstørrelse viser overlappede ark og krøllede kanter. Kredit:H -
 Teknik til fremstilling af keramiske film til OPV mellemlagFigur:Organiske fotovoltaiske solceller og skematisk figur af cellestrukturen. Strømdensitetsspænding (JV) karakteristika under lysbestråling og mørk tilstand. Kredit:Osaka University Efterhånden
Teknik til fremstilling af keramiske film til OPV mellemlagFigur:Organiske fotovoltaiske solceller og skematisk figur af cellestrukturen. Strømdensitetsspænding (JV) karakteristika under lysbestråling og mørk tilstand. Kredit:Osaka University Efterhånden -
 En eksotisk mikrobe og en usædvanlig udvindingsproces kan tilføje op til en økonomisk måde at la…WPI kemiingeniørprofessor Michael Timko med en prøve af isobutanol. Han hjælper med at udvikle en ny proces, der kan tilbyde en mere økonomisk måde at lave dette lovende biobrændstof på, som kunne bru
En eksotisk mikrobe og en usædvanlig udvindingsproces kan tilføje op til en økonomisk måde at la…WPI kemiingeniørprofessor Michael Timko med en prøve af isobutanol. Han hjælper med at udvikle en ny proces, der kan tilbyde en mere økonomisk måde at lave dette lovende biobrændstof på, som kunne bru
- Hvilke dyr lever i Pelagic Zone?
- Hvad får faldende genstande til at fremskynde, når de falder?
- Video:Hvordan blyanter kan hjælpe os med at forstå fremtiden for alting (Alex vil have en jetpack)…
- Forskere designer nyt blæk til 3D-printbar, bærbar bioelektronik
- Fremtrædende udsendte regler øger deltagelsen, reducere chikane online
- Hjemmeunderviste børn er langt mere socialt engagerede, end du måske tror


