Hvilken slags binding dannes, når atomer i et molekyle ikke deler deres valg ligeligt?
Når atomer i et molekyle ikke deler deres elektroner ligeligt, dannes en polær kovalent binding. I en polær kovalent binding trækkes elektronerne stærkere mod det ene atom end det andet. Dette skaber en delvis positiv ladning på atomet, der taber elektroner, og en delvis negativ ladning på atomet, der får elektroner. Polariteten af en kovalent binding bestemmes af forskellen i elektronegativitet mellem de to atomer. Elektronegativitet er et mål for et atoms evne til at tiltrække elektroner. Jo større forskellen er i elektronegativitet mellem to atomer, jo mere polær vil den kovalente binding være.
 Varme artikler
Varme artikler
-
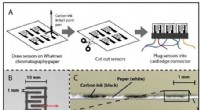 Madfriskhedssensorer kan erstatte sidste anvendelsesdatoer for at reducere madspild(A) Fremstilling af papirbaserede elektriske gassensorer (PEGS). Kulstofelektroder er trykt på WhatmanTM cellulosekromatografi 1 papir med en kuglepen og skæreplotter, tillader hurtig prototyping i de
Madfriskhedssensorer kan erstatte sidste anvendelsesdatoer for at reducere madspild(A) Fremstilling af papirbaserede elektriske gassensorer (PEGS). Kulstofelektroder er trykt på WhatmanTM cellulosekromatografi 1 papir med en kuglepen og skæreplotter, tillader hurtig prototyping i de -
 Ny proces fremskynder lægemiddelbehandlinger for virusinfektioner og kræftKredit:Simon Fraser University At opdage antivirale og anticancermedicin vil snart være hurtigere og billigere takket være ny forskning fra Simon Fraser University kemiker Robert Britton og hans i
Ny proces fremskynder lægemiddelbehandlinger for virusinfektioner og kræftKredit:Simon Fraser University At opdage antivirale og anticancermedicin vil snart være hurtigere og billigere takket være ny forskning fra Simon Fraser University kemiker Robert Britton og hans i -
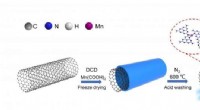 Mangan-enkeltatom-katalysator øger ydeevnen af elektrokemisk reduktion af kuldioxidSkematisk diagram af Mn SAC-fremstilling og mekanisme for elektrokemisk CO 2 reduktion. Kredit:FENG jiaqi Elektrokemisk CO 2 reduktionsreaktion (CO 2 RR) er en lovende tilgang til at omdanne
Mangan-enkeltatom-katalysator øger ydeevnen af elektrokemisk reduktion af kuldioxidSkematisk diagram af Mn SAC-fremstilling og mekanisme for elektrokemisk CO 2 reduktion. Kredit:FENG jiaqi Elektrokemisk CO 2 reduktionsreaktion (CO 2 RR) er en lovende tilgang til at omdanne -
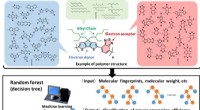 AI-software hjælper med design af nyt materiale til solcellerFig. 1. Udforskning af nye polymerer til polymersolceller ved hjælp af materialeinformatik. (Øvre) Eksempel på en polymerstruktur bestående af elektrondonor, elektronacceptor, og alkylkæder. (Mellem)
AI-software hjælper med design af nyt materiale til solcellerFig. 1. Udforskning af nye polymerer til polymersolceller ved hjælp af materialeinformatik. (Øvre) Eksempel på en polymerstruktur bestående af elektrondonor, elektronacceptor, og alkylkæder. (Mellem)
- Hvordan har europæiske ferskvandsfiskearter ændret sig over tid?
- Selvsamlende nanopartikler kunne forbedre MR-scanning til kræftdiagnose
- hvad er konklusionen på ikke-konventionel energikilde?
- Visualisering af elektronflow motiverer nye enheder i nanoskala inspireret af flyvinger
- Forskere finder måde at fremstille mineraler, som kan fjerne CO2 fra atmosfæren
- NASA udvikler værktøj, der viser, hvor meget havniveaustigning kystbyer kan forvente baseret på p…


