Hvad sker der, når stoffer opløses i vand?
1. Hydrering: Vandmolekyler er polære, hvilket betyder, at de har en let positiv ladning i den ene ende (brintatomer) og en lille negativ ladning i den anden ende (iltatom). Når en ionforbindelse, såsom natriumchlorid (NaCl), tilsættes vand, bliver de positive natriumioner (Na+) omgivet af de negative oxygenatomer i vandmolekyler, mens de negative chloridioner (Cl-) bliver omgivet af de positive hydrogenatomer i vandmolekyler. Denne proces med at omgive ioner med vandmolekyler er kendt som hydrering.
2. Dissociation: Nogle stoffer, såsom salte, syrer og baser, dissocieres, når de opløses i vand. Under dissociation bryder ioniske forbindelser fra hinanden i deres bestanddele. For eksempel, når NaCl opløses i vand, adskilles natrium- og chloridionerne og bliver omgivet af vandmolekyler. På samme måde, når syrer som saltsyre (HCl) opløses i vand, dissocieres hydrogenionerne (H+) og chloridionerne.
3. Ionisering: I nogle tilfælde kan stoffer undergå ionisering, når de opløses i vand. Ionisering opstår, når neutrale molekyler får eller mister elektroner, hvilket resulterer i dannelsen af ioner. For eksempel, når ammoniak (NH3) opløses i vand, accepterer et lille antal molekyler en hydrogenion (H+) fra vand og danner ammoniumioner (NH4+) og hydroxidioner (OH-).
4. Brintbinding: Vandmolekyler danner brintbindinger med hinanden på grund af elektronegativitetsforskellen mellem oxygen- og brintatomer. Når stoffer opløses i vand, kan de også deltage i hydrogenbinding med vandmolekyler. Denne interaktion bidrager til opløseligheden af mange polære molekyler, såsom alkoholer og sukkerarter.
Som et resultat af disse processer danner opløste stoffer en homogen blanding med vand, hvilket skaber en opløsning. Opløsningens egenskaber, såsom farve, smag og ledningsevne, afhænger af arten af det opløste stof og dets interaktioner med vandmolekyler.
Sidste artikelHvad er de to atomer, der udgør kuldioxid?
Næste artikelHvor mange p-orbitaler er optaget i et Ne-atom?
 Varme artikler
Varme artikler
-
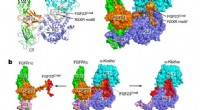 Forskere opdager strukturen af anti-aging hormonOverordnet topologi af FGF23-FGFR1cecto-α-klothoecto-komplekset. en, Tegneserie (venstre) og overfladerepræsentation (højre) af den ternære komplekse struktur. α-klotho KL1 (cyan) og KL2 (blå) domæner
Forskere opdager strukturen af anti-aging hormonOverordnet topologi af FGF23-FGFR1cecto-α-klothoecto-komplekset. en, Tegneserie (venstre) og overfladerepræsentation (højre) af den ternære komplekse struktur. α-klotho KL1 (cyan) og KL2 (blå) domæner -
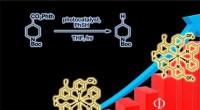 Inspireret af fotosyntese, forskere dobbeltreaktion kvanteeffektivitetReaktionens kvanteudbytte, sådan måler forskere effektiviteten af en lysaktiveret reaktion. Kredit:Anna Zieleniewska. Ud fra inspiration fra fotosyntese og den måde, hvorpå den kan opnå høj effe
Inspireret af fotosyntese, forskere dobbeltreaktion kvanteeffektivitetReaktionens kvanteudbytte, sådan måler forskere effektiviteten af en lysaktiveret reaktion. Kredit:Anna Zieleniewska. Ud fra inspiration fra fotosyntese og den måde, hvorpå den kan opnå høj effe -
 Ingeniørteamet opretter overvågningsværktøjssæt for at fremskynde produktionen af biologiske …Kredit:CC0 Public Domain To Rutgers University-ingeniører, der specialiserer sig i processen med at fremstille lægemidler afledt af levende organismer, har skabt et analytisk værktøj, som de forven
Ingeniørteamet opretter overvågningsværktøjssæt for at fremskynde produktionen af biologiske …Kredit:CC0 Public Domain To Rutgers University-ingeniører, der specialiserer sig i processen med at fremstille lægemidler afledt af levende organismer, har skabt et analytisk værktøj, som de forven -
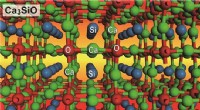 Opdagelse af ikke-toksiske halvledere med et direkte båndgab i det nær-infrarødeKrystalstruktur af den inverse perovskit Ca 3 SiO halvleder NIMS og Tokyo Institute of Technology har i fællesskab opdaget, at den kemiske forbindelse Ca 3 SiO er en direkte overgangs halvlede
Opdagelse af ikke-toksiske halvledere med et direkte båndgab i det nær-infrarødeKrystalstruktur af den inverse perovskit Ca 3 SiO halvleder NIMS og Tokyo Institute of Technology har i fællesskab opdaget, at den kemiske forbindelse Ca 3 SiO er en direkte overgangs halvlede
- Orkanen Michael når kategori 2, truer det sydlige USA
- Motiveret til at være uenig:Hvad kan man lære om hurtig polarisering fra den israelske retsreform?…
- Ny belægning bringer lithiummetalbatteri tættere på virkeligheden
- Revolutionær billedbehandlingsteknik bruger CRISPR til at kortlægge DNA-mutationer
- Økologiske virkninger af palmestearinudslip på kystøkosystemet
- Superopløsningsmikroskopi bygger flerfarvet 3-D fra 2-D


