Er en hydrogenbinding stærkere end kovalent binding?
Bindingsenergierne (enthalpierne) er i rækkefølgen:kovalent> brint> ionisk.
Kovalente bindinger er typisk stærkere end hydrogenbindinger, men undtagelser kan forekomme.
For eksempel er hydrogenbindinger i nogle tilfælde kendt for at være stærkere end visse typer kovalente bindinger, såsom dem, der dannes mellem kulstof og oxygen.
Styrken af en brintbinding bestemmes af forskellige faktorer, herunder elektronegativiteten af de involverede atomer, afstanden mellem brintatomet og det elektronegative atom og antallet af hydrogenbindinger dannet mellem molekylerne.
I kovalente bindinger deles elektroner mellem atomer, hvilket resulterer i en stærkere tiltrækning og en højere bindingsenergi, mens hydrogenbindinger dannes, når et brintatom, der er kovalent bundet til et elektronegativt atom, bliver tiltrukket af et andet elektronegativt atom, hvilket danner en yderligere intermolekylær binding.
Mens hydrogenbindinger kan være ret stærke, er de typisk svagere end kovalente bindinger, fordi de er ikke-kovalente interaktioner.
I en hydrogenbinding tiltrækkes hydrogenatomet til et elektronegativt atom som nitrogen, oxygen eller fluor gennem elektrostatiske interaktioner, hvilket fører til delvise positive og delvise negative ladninger på de deltagende atomer.
Disse bindinger er resultatet af dipol-dipol-interaktioner eller elektrostatiske interaktioner mellem de modsat ladede områder. I kovalente bindinger er elektronerne lokaliseret mellem atomerne, hvilket skaber en stærkere binding.
 Varme artikler
Varme artikler
-
 Forskere udvikler klæbemiddel med industriel styrke, som kan løsnes i magnetfeltetKredit:CC0 Public Domain Forskere ved University of Sussex har udviklet en lim, som kan løsne sig, når den placeres i et magnetfelt, dvs. produkter, der ellers er bestemt til deponering, kunne nu
Forskere udvikler klæbemiddel med industriel styrke, som kan løsnes i magnetfeltetKredit:CC0 Public Domain Forskere ved University of Sussex har udviklet en lim, som kan løsne sig, når den placeres i et magnetfelt, dvs. produkter, der ellers er bestemt til deponering, kunne nu -
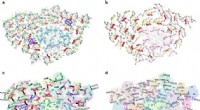 Strukturen af fotosystemprotein-superkompleks fra diatom afslører dets meget sofistikerede energi…Overordnet struktur af PSI-FCPI superkomplekset. Kredit:IBCAS Kiselalger er en gruppe af fytoplankton, der er vidt udbredt i hydrosfæren og endda i fugtig jord. De spiller vigtige roller i globale
Strukturen af fotosystemprotein-superkompleks fra diatom afslører dets meget sofistikerede energi…Overordnet struktur af PSI-FCPI superkomplekset. Kredit:IBCAS Kiselalger er en gruppe af fytoplankton, der er vidt udbredt i hydrosfæren og endda i fugtig jord. De spiller vigtige roller i globale -
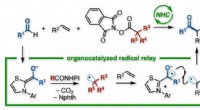 Vicinal reaktion:En radikal strategi for sammenkædning af tre organiske grupperEt japansk forskerteam ved Kanazawa University udviklede en reaktion for at skabe funktionaliserede ketoner. Ved hjælp af en N-heterocyklisk carbene (NHC) organokatalysator, uden behov for metaller el
Vicinal reaktion:En radikal strategi for sammenkædning af tre organiske grupperEt japansk forskerteam ved Kanazawa University udviklede en reaktion for at skabe funktionaliserede ketoner. Ved hjælp af en N-heterocyklisk carbene (NHC) organokatalysator, uden behov for metaller el -
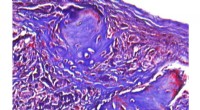 Nye hydrogeler viser lovende behandling af knogledefekterDer er vist et mikroskopisk billede af regenereret knogle i en kraniedefekt hos en mus. Kredit:University of California, Los Angeles Bioingeniører og tandlæger fra UCLA School of Dentistry har udv
Nye hydrogeler viser lovende behandling af knogledefekterDer er vist et mikroskopisk billede af regenereret knogle i en kraniedefekt hos en mus. Kredit:University of California, Los Angeles Bioingeniører og tandlæger fra UCLA School of Dentistry har udv


