Hvad vil man se, når eddikesyre reagerer med kaliumhydroxid?
1. Dannelse af kaliumacetat :
Reaktionen mellem eddikesyre og kaliumhydroxid resulterer i dannelsen af kaliumacetat (CH₃COOK). Dette salt fremstilles ved udveksling af hydrogenioner (H+) fra eddikesyre med kaliumioner (K+) fra kaliumhydroxid.
2. Neutraliseringsreaktion :
Eddikesyre er en svag syre, og kaliumhydroxid er en stærk base. Når de reagerer, opstår syre-base neutraliseringsreaktionen. Hydrogenionerne fra eddikesyre kombineres med hydroxidionerne (OH-) fra kaliumhydroxid og danner vand (H2O).
3. pH-ændring :
Før reaktionen er eddikesyre sur, og kaliumhydroxid er basisk. Efter reaktionen bliver den resulterende opløsning neutral eller let basisk på grund af dannelsen af kaliumacetat. Denne ændring i pH kan observeres ved hjælp af et pH-meter eller ved at tilføje en indikator såsom phenolphtalein, der bliver lyserødt i en basisk opløsning.
4. Varmefrigivelse :
Neutraliseringsreaktionen mellem eddikesyre og kaliumhydroxid er eksoterm, hvilket betyder, at den frigiver varme. Dette kan mærkes som en let temperaturstigning i reaktionsblandingen.
5. Dannelse af et salt :
Kaliumacetat, produktet af reaktionen, er et salt. Salte er ioniske forbindelser, der består af positivt ladede ioner (kationer) og negativt ladede ioner (anioner). I dette tilfælde virker kaliumioner (K+) som kationer, og acetationer (CH3COO-) virker som anioner.
Sammenfattende, når eddikesyre reagerer med kaliumhydroxid, kan følgende observationer gøres:dannelsen af kaliumacetat, en neutraliseringsreaktion, en ændring i pH, varmeafgivelse og dannelsen af et salt.
 Varme artikler
Varme artikler
-
 Fra orkaner til jordskælv, rumstationseksperiment overvinder udfordringerCamila Morales-Navas udfører de sidste forberedelser på det elektrokemiske ammoniakfjernelsessystem forud for parabolflyvningstest. Kredit:University of Puerto Rico Pladsen er hård, ordsproget sig
Fra orkaner til jordskælv, rumstationseksperiment overvinder udfordringerCamila Morales-Navas udfører de sidste forberedelser på det elektrokemiske ammoniakfjernelsessystem forud for parabolflyvningstest. Kredit:University of Puerto Rico Pladsen er hård, ordsproget sig -
 Ny miljøvenlig kødanalog sundere, tilbyder flere smagsoplevelserKredit:Pixabay/CC0 Public Domain Et team af forskere fra Kaunas University of Technology (KTU), Litauen og Universitetet i Helsinki har foreslået en ekstremt nærende kødanalog ved hjælp af ferment
Ny miljøvenlig kødanalog sundere, tilbyder flere smagsoplevelserKredit:Pixabay/CC0 Public Domain Et team af forskere fra Kaunas University of Technology (KTU), Litauen og Universitetet i Helsinki har foreslået en ekstremt nærende kødanalog ved hjælp af ferment -
 Support vokser til bæredygtig metode til fremstilling af kompositfiberpladerForskere fra Purdue University har udviklet en lavere pris, bæredygtig og grønnere metode til fremstilling af sammensatte plader - en metode, der allerede oplever voksende støtte fra store brancheaktø
Support vokser til bæredygtig metode til fremstilling af kompositfiberpladerForskere fra Purdue University har udviklet en lavere pris, bæredygtig og grønnere metode til fremstilling af sammensatte plader - en metode, der allerede oplever voksende støtte fra store brancheaktø -
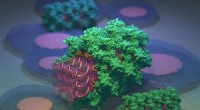 DNA nanostrukturer bliver camoufleret af proteinerDNA-nanostrukturer (lilla) bliver camoufleret af serumalbuminproteiner (grøn). Kredit:Veikko Linko og Mauri Kostiainen Forskere fra Aalto University og Helsinki University har rapporteret en strat
DNA nanostrukturer bliver camoufleret af proteinerDNA-nanostrukturer (lilla) bliver camoufleret af serumalbuminproteiner (grøn). Kredit:Veikko Linko og Mauri Kostiainen Forskere fra Aalto University og Helsinki University har rapporteret en strat
- Effekter af Hydrogen Bomb
- Ny numerisk metode gør det muligt at simulere jordskred-tsunamier
- Hvordan fugleflokke med flere arter opfører sig som K-pop-grupper
- Vil du klare dine tests? Tag noter i hånden
- Hvad FCC-tilbagetrækningen af 'netneutralitet' betyder for dig
- Hvorfor varer polygami i bymiljøer?


