Hvad er svage bindinger, der ikke er stærke nok til at holde atomer sammen danner molekyler, men inden for og omkring store molekyler?
1. Van der Waals styrker:
- Van der Waals kræfter er de svageste af de intermolekylære kræfter og opstår mellem alle molekyler.
- De består af tre komponenter:
- London spredningskræfter:Dette er midlertidige tiltrækningskræfter, der opstår på grund af fluktuationerne i elektronfordelingen i molekyler.
- Dipol-inducerede dipolkræfter:Disse kræfter opstår, når en permanent dipol i et molekyle inducerer en midlertidig dipol i et nabomolekyle.
- Permanente dipol-permanente dipolkræfter:Disse kræfter opstår mellem molekyler med permanente dipoler.
2. Hydrogenbindinger:
- Hydrogenbindinger er stærke dipol-dipol-interaktioner, der forekommer mellem et stærkt elektronegativt atom (normalt F, O eller N) og et brintatom, der er kovalent bundet til et andet stærkt elektronegativt atom.
- Hydrogenbindinger er stærkere end van der Waals-kræfter, men svagere end kovalente bindinger.
3. Dipol-dipol-interaktioner:
- Dipol-dipol-interaktioner forekommer mellem molekyler med permanente dipoler. Den positive ende af en dipol tiltrækkes af den negative ende af en anden dipol, hvilket resulterer i en nettotiltrækningskraft.
4. Ioniske interaktioner:
- Ioniske interaktioner er elektrostatiske kræfter mellem positivt ladede ioner (kationer) og negativt ladede ioner (anioner).
- Ioniske vekselvirkninger er stærkere end hydrogenbindinger og dipol-dipol vekselvirkninger, men svagere end kovalente bindinger.
Sidste artikelHvilken type binding er der i grafit?
Næste artikelHvad vil man se, når eddikesyre reagerer med kaliumhydroxid?
 Varme artikler
Varme artikler
-
 Forskere udvikler bionedbrydeligt trykt displayTakket være dens fleksibilitet og vedhæftning, det bionedbrydelige display kan bæres direkte på hånden. Kredit:Manuel Pietsch, KIT I de næste år, stigende brug af elektroniske enheder i forbrugsva
Forskere udvikler bionedbrydeligt trykt displayTakket være dens fleksibilitet og vedhæftning, det bionedbrydelige display kan bæres direkte på hånden. Kredit:Manuel Pietsch, KIT I de næste år, stigende brug af elektroniske enheder i forbrugsva -
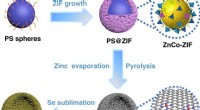 Team afslører en enkel metode til at producere højtydende lithium-selenbatterierSAC forberedelsesproces. Kredit: Naturkommunikation (2020). DOI:10.1038/s41467-020-18820-y Genopladelige lithium-ion-batterier (LIBer) betragtes som det bedste håb for næste generations batterite
Team afslører en enkel metode til at producere højtydende lithium-selenbatterierSAC forberedelsesproces. Kredit: Naturkommunikation (2020). DOI:10.1038/s41467-020-18820-y Genopladelige lithium-ion-batterier (LIBer) betragtes som det bedste håb for næste generations batterite -
 Din næste træstol kunne ankomme flad og derefter tørre til en 3D-formTræblæk trykt som et fladt rektangel er programmeret til at danne en kompleks form efter tørring og størkning. (Lineal er markeret i centimeter.). Kredit:Doron Kam Trægenstande fremstilles normalt
Din næste træstol kunne ankomme flad og derefter tørre til en 3D-formTræblæk trykt som et fladt rektangel er programmeret til at danne en kompleks form efter tørring og størkning. (Lineal er markeret i centimeter.). Kredit:Doron Kam Trægenstande fremstilles normalt -
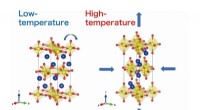 Undersøgelse undersøger bemærkelsesværdig negativ termisk ekspansion set i lagdelte ruthenaterDe strukturelle forvrængninger i Ca 2 RuO 4 er ansvarlige for dens anisotrope termiske ekspansion. Kredit:Masaki Azuma fra Tokyo Institute of Technology En tidligere ubemærket monoklinisk forv
Undersøgelse undersøger bemærkelsesværdig negativ termisk ekspansion set i lagdelte ruthenaterDe strukturelle forvrængninger i Ca 2 RuO 4 er ansvarlige for dens anisotrope termiske ekspansion. Kredit:Masaki Azuma fra Tokyo Institute of Technology En tidligere ubemærket monoklinisk forv
- Undersøgelse viser, hvorfor luftforureningsniveauet i det østlige USA er mere stagnerende om vinte…
- Observerer udviklingen af et dybhavs drivhusgasfilter
- Amazonas atmosfæres skiftende kemi
- Transkønnede amerikanere er mere tilbøjelige til at være arbejdsløse og fattige
- Billede:Lytte til Cassini
- Bærbare sensorer efterligner hud for at hjælpe med sårhelingsprocessen


