Hvilken type binding er der i grafit?
 Varme artikler
Varme artikler
-
 Ny platform til at skabe og karakterisere materialeblandinger kan fremskynde udviklingen markantYale University ph.d.-studerende Kristof Toth (billedet ovenfor) med det elektrosprayaflejringsværktøj, han designede, bygget, og valideret i samarbejde med stabsforsker Gregory Doerk fra Brookhaven L
Ny platform til at skabe og karakterisere materialeblandinger kan fremskynde udviklingen markantYale University ph.d.-studerende Kristof Toth (billedet ovenfor) med det elektrosprayaflejringsværktøj, han designede, bygget, og valideret i samarbejde med stabsforsker Gregory Doerk fra Brookhaven L -
 Analyse af biologiske og kemiske skader på byggematerialer fra det 20. århundredeDr. Iratxe Ibarrondo bruger bærbare højopløsningsspektroskopiske teknikker til at analysere påvirkningen på det 20. århundredes byggematerialer af miljøet og de biologiske forhold i det omkringliggend
Analyse af biologiske og kemiske skader på byggematerialer fra det 20. århundredeDr. Iratxe Ibarrondo bruger bærbare højopløsningsspektroskopiske teknikker til at analysere påvirkningen på det 20. århundredes byggematerialer af miljøet og de biologiske forhold i det omkringliggend -
 Den rigtige formel til skalering af produktion af lovende materiale til dekontaminering af vandForskernes metode giver dem mulighed for at oprette en meget større mængde MoS 2 til en lavere pris. Kredit:University of Texas i Austin. Et internationalt team af forskere har fundet en måde at
Den rigtige formel til skalering af produktion af lovende materiale til dekontaminering af vandForskernes metode giver dem mulighed for at oprette en meget større mængde MoS 2 til en lavere pris. Kredit:University of Texas i Austin. Et internationalt team af forskere har fundet en måde at -
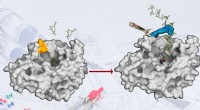 Ny teknologi til enzymdesignOverfladen af enzymet levansucrase er redesignet til fremstilling af sukkerpolymerer. Kredit:AK Seibel Forskere ved universitetet i Würzburg har kemisk ændret enzymet levansucrase ved hjælp af e
Ny teknologi til enzymdesignOverfladen af enzymet levansucrase er redesignet til fremstilling af sukkerpolymerer. Kredit:AK Seibel Forskere ved universitetet i Würzburg har kemisk ændret enzymet levansucrase ved hjælp af e
- Wolframsubstitueret vanadiumoxid indånder frisk luft i katalysatorteknologi
- 20 procent af amerikanerne er ansvarlige for næsten halvdelen af de amerikanske fødevarerelatere…
- Europas exoplanetjæger når i kredsløb om Jorden
- Naturgassens usikre rolle i overgangen til ren energi
- Verdens første produktion af aluminium scandium nitrid via MOCVD
- Lava, askestrømme, mudderskred og grimme gasser - gode grunde til at respektere vulkaner


