Hvilken type interaktion er vigtigst i en løsning, olie og benzin?
Sidste artikelHvad gør farver komplementære?
Næste artikelHvad er pH-værdien af Maalox?
 Varme artikler
Varme artikler
-
 Ny bærerdoping i p-type halvledere forbedrer fotovoltaisk enheds ydeevne ved at øge hulkoncentrati…Grafisk abstrakt. Kredit:Tokyo Tech Perovskite-solceller har været genstand for megen forskning som den næste generation af solceller. Der er dog stadig mange udfordringer, der skal overvindes for
Ny bærerdoping i p-type halvledere forbedrer fotovoltaisk enheds ydeevne ved at øge hulkoncentrati…Grafisk abstrakt. Kredit:Tokyo Tech Perovskite-solceller har været genstand for megen forskning som den næste generation af solceller. Der er dog stadig mange udfordringer, der skal overvindes for -
 Test for livstruende næringsstofunderskud er lavet af bakteriers indvoldeZinkmangeltesten bliver lilla for at angive sundhedsmæssige zinkniveauer, men forbliver gul, når zinkniveauet er farligt lavt. Der blev ikke brugt blod til dette testdemobillede. Kredit:Georgia Tech /
Test for livstruende næringsstofunderskud er lavet af bakteriers indvoldeZinkmangeltesten bliver lilla for at angive sundhedsmæssige zinkniveauer, men forbliver gul, når zinkniveauet er farligt lavt. Der blev ikke brugt blod til dette testdemobillede. Kredit:Georgia Tech / -
 Ny tilgang til gasfangst fremmer styring af atombrændstofAdskillelse af 85 Kr fra brugt nukleart brændstof ved en meget selektiv metalorganisk ramme. Kredit:Mike Gipple/NETL Atomenergi leverer omkring 20 procent af den amerikanske elforsyning, og over
Ny tilgang til gasfangst fremmer styring af atombrændstofAdskillelse af 85 Kr fra brugt nukleart brændstof ved en meget selektiv metalorganisk ramme. Kredit:Mike Gipple/NETL Atomenergi leverer omkring 20 procent af den amerikanske elforsyning, og over -
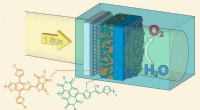 Et kunstigt blad lavet af halvledende polymererGenerering af ilt fra sollys, vand og halvledende polymerer. Kredit:LIMNO / EPFL EPFL-forskere genererer ilt fra sollys, vand og halvledende polymerer. De præsenterer en lovende vej mod økonomisk
Et kunstigt blad lavet af halvledende polymererGenerering af ilt fra sollys, vand og halvledende polymerer. Kredit:LIMNO / EPFL EPFL-forskere genererer ilt fra sollys, vand og halvledende polymerer. De præsenterer en lovende vej mod økonomisk
- Hvilken intermolekylær kraft vil mindst påvirke kogepunktet?
- Intuition og fiasko er værdifulde ingredienser i kemi
- Essay:Vil den første ændring overleve informationsalderen?
- Forskere løser mysteriet om, hvordan gasbobler dannes i væske
- Sådan Find Procenten af Længde i Tommer
- Er folk mere tilbøjelige til at reducere deres kalorieindtag på restauranter, når menuerne indeho…


