Er svovl mere reaktivt end fosfor?
Svovl er placeret under ilt i gruppe 16 (også kendt som iltfamilien) i det periodiske system. Når vi bevæger os ned ad en gruppe i det periodiske system, øges atomradius, og ioniseringsenergien falder. Det betyder, at valenselektronerne i svovl holdes mere løst og fjernes lettere, hvilket gør svovl mere reaktivt end oxygen.
I modsætning hertil er fosfor placeret under svovl i gruppe 15 (også kendt som nitrogenfamilien) i det periodiske system. Fosfor har en mindre atomradius og højere ioniseringsenergi end svovl. Det betyder, at valenselektronerne i fosfor holdes tættere fast og ikke så let fjernes, hvilket gør fosfor mindre reaktivt end svovl.
Svovls reaktivitet er også påvirket af dets lavere elektronegativitet sammenlignet med fosfor. Elektronegativitet er et atoms evne til at tiltrække elektroner. Svovls lavere elektronegativitet betyder, at det har en svagere tiltrækning af elektroner, hvilket gør det mere tilbøjeligt til at miste elektroner og gennemgå kemiske reaktioner.
Derfor, baseret på positionen i det periodiske system, atomare egenskaber og elektronegativitet, er svovl mere reaktivt end fosfor.
Sidste artikelHvad er antallet af valenselektroner i cdmium cd?
Næste artikelHvor mange ioner er der i mælkesyre?
 Varme artikler
Varme artikler
-
 Forskere udvikler den kemi, der er nødvendig for at skabe et alkometer til marihuanaLegaliseringen og afkriminaliseringen af marihuana i Californien og andre steder har gjort afsløring af marihuana særlig vigtig, sagde seniorforfatter Neil Garg. Kredit:Jesse Herring UCLA-kemike
Forskere udvikler den kemi, der er nødvendig for at skabe et alkometer til marihuanaLegaliseringen og afkriminaliseringen af marihuana i Californien og andre steder har gjort afsløring af marihuana særlig vigtig, sagde seniorforfatter Neil Garg. Kredit:Jesse Herring UCLA-kemike -
 Ny algoritme afslører cellefabrikkers hemmelighederForskerne testede deres model ved at simulere stofskifte i mere end 300 typer gær. Sammenlignet med målt, allerede eksisterende viden, konkluderede forskerne, at modeller med forudsagte kcat-værdier n
Ny algoritme afslører cellefabrikkers hemmelighederForskerne testede deres model ved at simulere stofskifte i mere end 300 typer gær. Sammenlignet med målt, allerede eksisterende viden, konkluderede forskerne, at modeller med forudsagte kcat-værdier n -
 Kemiteknik er kædedrev for at skabe bedre syntetiske molekyler til medicinKredit:CC0 Public Domain I en undersøgelse med implikationer for fremtiden for lægemiddelopdagelse, Forskere fra Scripps Research viste, at de var i stand til at omdanne simple kemikalier til unik
Kemiteknik er kædedrev for at skabe bedre syntetiske molekyler til medicinKredit:CC0 Public Domain I en undersøgelse med implikationer for fremtiden for lægemiddelopdagelse, Forskere fra Scripps Research viste, at de var i stand til at omdanne simple kemikalier til unik -
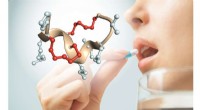 Peptider, der kan tages som en pilleStruktur af et dobbeltbro-peptid, der ikke nedbrydes af enzymer i mave og tarme. De to stabiliserende kemikaliebroer er vist med rødt. Kredit:C. Heinis (EPFL) Peptider er korte kæder af aminosyrer
Peptider, der kan tages som en pilleStruktur af et dobbeltbro-peptid, der ikke nedbrydes af enzymer i mave og tarme. De to stabiliserende kemikaliebroer er vist med rødt. Kredit:C. Heinis (EPFL) Peptider er korte kæder af aminosyrer
- Sådan minimeres støjforurening
- Netflix bagatelliserer teenageres smerte, siger undersøgelse
- Insider Q&A:Facebooks VP for Messenger diskuterer privatliv
- Bedre metoder forbedrer målinger af rekreativt vandkvalitet
- Undersøgelse afdækker økonomiske konsekvenser af naturkatastrofer
- Kolliderende molekyler og antipartikler


