Hvorfor er zink i stand til at fortrænge guld, der blev udvasket fra en malm?
Reaktionen mellem zink og guld kan repræsenteres ved følgende ligning:
$$Zn(s) + 2Au^3+(aq) → 2Au(s) + Zn^2+(aq)$$
I denne reaktion oxideres zinkatomerne fra en neutral tilstand til en +2 oxidationstilstand, mens guldionerne reduceres fra en +3 oxidationstilstand til en neutral tilstand. De faste guldatomer fælder derefter ud af opløsningen, mens zinkionerne forbliver i opløsning.
Zinks evne til at fortrænge guld skyldes dets lavere reaktivitet sammenlignet med guld. Det betyder, at zink lettere oxideres end guld, og derfor er den mere villig til at opgive sine elektroner. Denne forskel i reaktivitet er det, der driver cementeringsprocessen.
Processen med cementering er almindeligt anvendt i mineindustrien til at udvinde guld fra malme. Malmen udvaskes først med en cyanidopløsning, som opløser guldet. Den guldrige opløsning ledes derefter gennem et leje af zinkspåner, hvor zinkatomerne fortrænger guldionerne fra opløsningen. Guldatomerne fælder derefter ud af opløsningen og kan opsamles.
Sidste artikelHvorfor er atomer arrangeret i perioder?
Næste artikelHører bor til metalfamilien?
 Varme artikler
Varme artikler
-
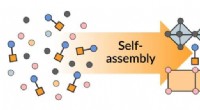 En enkel måde at få komplekse halvledere til at samle sig selvEt diagram viser, hvordan lag af to 2D-materialer – en perovskit (blå) og et metalhalogenid (gul) – samler sig ud af kemikalier, der vælter rundt i vand (til venstre). Forsamlingen styres af linkermol
En enkel måde at få komplekse halvledere til at samle sig selvEt diagram viser, hvordan lag af to 2D-materialer – en perovskit (blå) og et metalhalogenid (gul) – samler sig ud af kemikalier, der vælter rundt i vand (til venstre). Forsamlingen styres af linkermol -
 Teamet tester virkningerne af ilt på uranVist på en stor computerskærm er et Raman-spektrum af uranoxidpartikler dannet inde i holdets reaktionskammer på bænken. Det viste uranoxidspektrum er for U3 O8 . Kredit:Julie Russell/LLNL Et team
Teamet tester virkningerne af ilt på uranVist på en stor computerskærm er et Raman-spektrum af uranoxidpartikler dannet inde i holdets reaktionskammer på bænken. Det viste uranoxidspektrum er for U3 O8 . Kredit:Julie Russell/LLNL Et team -
 PolymerkraftpotentialeKredit:Agency for Science, Teknologi og forskning (A*STAR), Singapore Mantraet reducere, genbruge, genbrug er mere og mere relevant. Hvert år, enorme mængder energi, der kunne opsamles og genbruge
PolymerkraftpotentialeKredit:Agency for Science, Teknologi og forskning (A*STAR), Singapore Mantraet reducere, genbruge, genbrug er mere og mere relevant. Hvert år, enorme mængder energi, der kunne opsamles og genbruge -
 Forskere bruger kunstige neurale netværk til at strømline materialetestningNikhil Gupta, lektor i maskin- og rumfartsteknik og ph.d. studerende Xianbo Xu. Kredit:NYU Tandon School of Engineering Optimering af avancerede kompositter til specifikke slutanvendelser kan være
Forskere bruger kunstige neurale netværk til at strømline materialetestningNikhil Gupta, lektor i maskin- og rumfartsteknik og ph.d. studerende Xianbo Xu. Kredit:NYU Tandon School of Engineering Optimering af avancerede kompositter til specifikke slutanvendelser kan være
- Exoplaneter:fristende søgen efter liv hinsides solsystemet
- Hvordan Australiens geologi gav os en overflod af kul og et væld af grønne teknologiske mineraler …
- Samarbejde er nøglen til at håndtere klimaændringer
- Sådan konverteres eksponenter til Logs
- Nyt softwareværktøj udtrækker vigtige kemiske eksponeringsdata
- Rødderne til biodiversitet:Hvordan proteiner adskiller sig på tværs af arter


