Hvordan bliver et atom stabilt?
1. Fuldførelse af den ydre elektronskal (oktetregel):
"Oktetreglen" eller "duetreglen" siger, at atomer har tendens til at vinde, miste eller dele elektroner for at opnå en stabil elektronkonfiguration ved at have en fuld yderste elektronskal. Dette resulterer i en mere stabil og lavere energitilstand for atomet. For eksempel:
- Natrium (Na) har én elektron i sin yderste skal. Den opnår stabilitet ved at miste denne elektron, hvilket resulterer i en fuld yderste elektronskal med en ædelgaskonfiguration (Ne).
- Klor (Cl) har syv elektroner i sin yderste skal. Det bliver stabilt ved at få en elektron til at fuldføre dens yderste elektronskal og opnå samme konfiguration som en ædelgas (Ar).
2. Dannelse af kemiske bindinger:
Atomer kan også opnå stabilitet ved at danne kemiske bindinger med andre atomer. Kemisk binding involverer deling eller overførsel af elektroner mellem atomer, hvilket resulterer i en mere stabil konfiguration for de bundne atomer. Der er forskellige typer kemiske bindinger, herunder:
- Ionbindinger:Ved ionbinding mister et atom elektroner, mens et andet får elektroner, hvilket resulterer i dannelsen af modsat ladede ioner. Den elektrostatiske tiltrækning mellem disse ioner holder sammensætningen sammen og skaber stabilitet.
- Kovalente bindinger:Kovalent binding involverer deling af elektronpar mellem atomer. Denne deling af elektroner resulterer i en stabil elektronkonfiguration for hvert atom.
- Metalliske bindinger:Ved metallisk binding deles elektroner mellem mange metalatomer og danner et "hav" af elektroner, der holder metalgitteret sammen, hvilket giver styrke og stabilitet.
Ved at opnå en fuld yderste elektronskal eller ved at danne kemiske bindinger opnår atomer en lavere energitilstand og bliver stabile.
Sidste artikelHvad er reaktionen mellem natrium og brom?
Næste artikelHvordan renser man en sølvring, der er faldet i Clorox?
 Varme artikler
Varme artikler
-
 Kompleks stofskifte kan have samlet sig selv fra simple prækursorerEn reaktion af thioeddikesyre, thioler og jernproducerende thioestere og et jernsulfidmineral. Kredit:Sebastian Sanden, ELSI. Alt moderne liv bruger energi til at reproducere sig selv. Under denne
Kompleks stofskifte kan have samlet sig selv fra simple prækursorerEn reaktion af thioeddikesyre, thioler og jernproducerende thioestere og et jernsulfidmineral. Kredit:Sebastian Sanden, ELSI. Alt moderne liv bruger energi til at reproducere sig selv. Under denne -
 Polymer, der heler som hud meget tæt på produktion i industriel skalaMarek Urban arbejder i sit Clemson University laboratorium med sine studerende. Kredit:Clemson University Omkostningerne ved fremstilling af plast, maling, belægninger til mobiltelefonskærme og an
Polymer, der heler som hud meget tæt på produktion i industriel skalaMarek Urban arbejder i sit Clemson University laboratorium med sine studerende. Kredit:Clemson University Omkostningerne ved fremstilling af plast, maling, belægninger til mobiltelefonskærme og an -
 Udskrivning af flydende metaller i tredimensionelle strukturerBrug af 3-D printteknikken til at omkonfigurere en firkantet spoleantenne. Kredit:Science Advances, doi:10.1126/sciadv.aaw2844 I en nylig undersøgelse om materialevidenskab og nanomedicin, Young-G
Udskrivning af flydende metaller i tredimensionelle strukturerBrug af 3-D printteknikken til at omkonfigurere en firkantet spoleantenne. Kredit:Science Advances, doi:10.1126/sciadv.aaw2844 I en nylig undersøgelse om materialevidenskab og nanomedicin, Young-G -
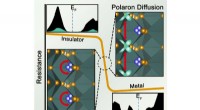 Team kaster nyt lys over design af uorganiske materialer til hjernelignende databehandlingFigur, der viser kobberionbevægelsen inden for et stift gitter af vanadium og ilt som kæden af en elektrisk ledningsevneændring i det kamæleonlignende materiale, der kan udnyttes til at skabe elektr
Team kaster nyt lys over design af uorganiske materialer til hjernelignende databehandlingFigur, der viser kobberionbevægelsen inden for et stift gitter af vanadium og ilt som kæden af en elektrisk ledningsevneændring i det kamæleonlignende materiale, der kan udnyttes til at skabe elektr
- Forskere viser indflydelse af nanopartikler på næringsstofabsorption
- Samtaler med planter:Kan vi give planter forudgående advarsel om forestående farer?
- Forskere undervurderede potentialet for Tohoku-skælvet. Hvad nu?
- Archimedes skrue inspirerer forskere til at udtænke en ny laserstråle, der fanger partikler
- Colorados berømte asper forventes at falde på grund af klimaændringer
- Er egenskaber såsom lugt farvetæthed og opløselighed fysiske eller kemiske egenskaber?


