Prøve, der vejede 1,5 g, viste sig kun at indeholde Mn og S. Den reagerede fuldstændigt med ilt og producerede 1,22 g MnIIoxid 1,38 svovltrioxid. Hvad er den enkleste formelforbindelse?
Trin 1:Beregn mol af Mn og S i forbindelsen.
- Mol af Mn =(masse af Mn) / (molær masse af Mn)
=(masse af Mn i oxidet - masse af Mn i prøven) / (molær masse af Mn)
=(1,22 g - 0,5 g) / (54,94 g/mol)
=0,0134 mol
- Mol af S =(masse af S) / (molær masse af S)
=(masse af S i oxidet - masse af S i prøven) / (molær masse af S)
=(1,38 g - 0,5 g) / (32,06 g/mol)
=0,0274 mol
Trin 2:Bestem molforholdet mellem Mn og S.
- Divider hvert grundstofs mol med det mindste antal mol for at opnå det enkleste hele talforhold.
- Mn:S =0,0134 mol / 0,0134 mol :0,0274 mol / 0,0134 mol
- Mn:S =1 :2
Trin 3:Skriv den empiriske formel.
- Forbindelsens enkleste formel er MnS, da molforholdet mellem Mn og S er 1:2.
Sidste artikelHvilke elementer er ikke en sølv-hvid eller sølvgrå mørkegrå farve?
Næste artikelHvilke stoffer er reaktanter i respirationen?
 Varme artikler
Varme artikler
-
 Forskere bruger mikrobølger til at måle tegn på dehydreringBillede, der viser mikrobølgesensorteknologisystem, der måler dråbe blod. Kredit:Queen Mary, University of London London og National Physical Laboratory (NPL) har med succes brugt mikrobølger til
Forskere bruger mikrobølger til at måle tegn på dehydreringBillede, der viser mikrobølgesensorteknologisystem, der måler dråbe blod. Kredit:Queen Mary, University of London London og National Physical Laboratory (NPL) har med succes brugt mikrobølger til -
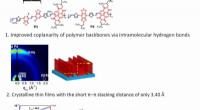 Organisk elektronik:Forskere udvikler en højtydende unipolær n-type tyndfilmstransistorRationelt design af elektrontransporterende organiske halvledende polymerer og deres tyndfilmsanalyse og transistorpræstationer. Kredit: Journal of the American Chemical Society Forskere ved Toky
Organisk elektronik:Forskere udvikler en højtydende unipolær n-type tyndfilmstransistorRationelt design af elektrontransporterende organiske halvledende polymerer og deres tyndfilmsanalyse og transistorpræstationer. Kredit: Journal of the American Chemical Society Forskere ved Toky -
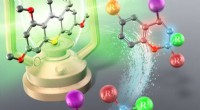 Lad der være lys:Syntetisering af organiske forbindelserBilledet illustrerer den grønt-lys-drevne produktion af oxygen-heterocykler. Kredit:Yokohama National University Enhver biologisk reaktion er en kemisk reaktion. Udveksling af kuldioxid med ilt i
Lad der være lys:Syntetisering af organiske forbindelserBilledet illustrerer den grønt-lys-drevne produktion af oxygen-heterocykler. Kredit:Yokohama National University Enhver biologisk reaktion er en kemisk reaktion. Udveksling af kuldioxid med ilt i -
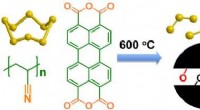 Svovl giver et lovende næste generations batterialternativEn skematisk illustration af dannelsen af kemisk bindingsstabiliseret kulstof-svovlkomposit. Kredit:C. Luo Med den stigende efterspørgsel efter økonomisk overkommelig og bæredygtig energi, den l
Svovl giver et lovende næste generations batterialternativEn skematisk illustration af dannelsen af kemisk bindingsstabiliseret kulstof-svovlkomposit. Kredit:C. Luo Med den stigende efterspørgsel efter økonomisk overkommelig og bæredygtig energi, den l
- Hvad hvis Hoover -dæmningen brød?
- Vil koralrev forsvinde?
- Hvorfor du skal sige 'tak' og ikke 'undskyld' efter de fleste servicefejl
- Regnvand kan være en stor kilde til mikroplast og gummifragmenter til vandveje
- Fysikere viser en ny Mott-tilstand i snoede grafen-dobbeltlag i 'magisk vinkel'
- Luftkvaliteten på mange togstationer er alarmerende dårlig - her er, hvordan du forbedrer den


