Hvorfor er natriumhydroxid stærkere end ammoniak?
Der er et par grunde til, at natriumhydroxid er en stærkere base end ammoniak:
1. Elektronegativitet :Natrium er et metal, og ammoniak er et ikke-metal. Metaller er generelt mindre elektronegative end ikke-metaller, hvilket betyder, at de har en svagere tiltrækning af elektroner. Det betyder, at hydroxidionen (OH-) i natriumhydroxid har en stærkere tiltrækning for H+ ioner end ammoniakmolekylet (NH3).
2. Løsning :Natriumhydroxid er en meget opløselig forbindelse i vand, mens ammoniak kun er moderat opløselig. Det betyder, at der er flere OH-ioner tilgængelige i en opløsning af natriumhydroxid, end der er NH3-molekyler i en opløsning af ammoniak. Jo flere ioner der er i en opløsning, jo mere effektiv er basen til at acceptere H+ ioner.
3. Dissociation :Natriumhydroxid dissocierer fuldstændigt i vand, hvilket betyder, at alle NaOH-molekylerne bryder sammen i Na+ og OH- ioner. Ammoniak, på den anden side, dissocierer kun delvist i vand, hvilket betyder, at nogle af NH3-molekylerne forbliver intakte som neutrale molekyler. Jo mere en forbindelse dissocierer i vand, jo mere effektiv er basen til at acceptere H+ ioner.
Som et resultat af disse faktorer er natriumhydroxid en stærkere base end ammoniak. Dette betyder, at det er mere effektivt til at acceptere H+-ioner og kan hæve pH-værdien af en opløsning mere effektivt.
Sidste artikelEr ammoniak eller hydroxid en stærkere syre?
Næste artikelHvad er en stærkere base Ammoniak eller natriumhydroxid?
 Varme artikler
Varme artikler
-
 Selvrensende beton kan få bygninger til at se nye udSelvrensende beton kunne holde bygninger til at se ud som nye ved at afvise alle slags væsker, såsom kaffe og mælk. Kredit:American Chemical Society Byggematerialer, der renser sig selv, kan spare
Selvrensende beton kan få bygninger til at se nye udSelvrensende beton kunne holde bygninger til at se ud som nye ved at afvise alle slags væsker, såsom kaffe og mælk. Kredit:American Chemical Society Byggematerialer, der renser sig selv, kan spare -
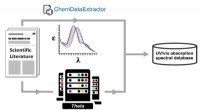 Automatisk databaseoprettelse til materialeopdagelse:Innovation fra frustrationAutogenerering af en ultraviolet-synlig (UV-vis) absorptionsspektral database via en dobbelt eksperimentel og beregningsmæssig kemisk datavej ved hjælp af ALCFs Theta-supercomputer. Kredit:Jacqueline
Automatisk databaseoprettelse til materialeopdagelse:Innovation fra frustrationAutogenerering af en ultraviolet-synlig (UV-vis) absorptionsspektral database via en dobbelt eksperimentel og beregningsmæssig kemisk datavej ved hjælp af ALCFs Theta-supercomputer. Kredit:Jacqueline -
 Ny isomerseparationsmetode er en velsignelse for forskning i proteinoxidationKemikere ved UC Santa Cruz rapporterede om en ny metode til adskillelse af methioninsulfoxiddiastereomerer, der åbner nye muligheder for at studere deres roller i biologiske processer. Kredit:Omslagsk
Ny isomerseparationsmetode er en velsignelse for forskning i proteinoxidationKemikere ved UC Santa Cruz rapporterede om en ny metode til adskillelse af methioninsulfoxiddiastereomerer, der åbner nye muligheder for at studere deres roller i biologiske processer. Kredit:Omslagsk -
 Udvikling af en måde at gøre oxygen injicerbarJarad Mason og hans team har skabt permanent porøst vand, hvilket gør det muligt at opbevare gasser i høje koncentrationer i væsken. Kredit:Kris Snibbe/Harvard Staff Photographer Hvad hvis akutmedi
Udvikling af en måde at gøre oxygen injicerbarJarad Mason og hans team har skabt permanent porøst vand, hvilket gør det muligt at opbevare gasser i høje koncentrationer i væsken. Kredit:Kris Snibbe/Harvard Staff Photographer Hvad hvis akutmedi


