Hvilke produktforhold kunne have været observeret i dette eksperiment, hvis et aprotisk opløsningsmiddel såsom dimethylsulfoxid havde været brugt i stedet for vand?
Hvis et aprotisk opløsningsmiddel såsom dimethylsulfoxid (DMSO) var blevet brugt i stedet for vand, kunne produktforholdene have været anderledes. Aprotiske opløsningsmidler, som mangler sure hydrogener, kan påvirke reaktionsligevægten og ændre produktfordelingen. Her er hvad der kunne være sket:
1. Øget dannelse af den cykliske hydrazon (produkt A): Aprotiske opløsningsmidler som DMSO har en højere polaritet end vand, men er mindre tilbøjelige til at deltage i hydrogenbinding. Dette betyder, at DMSO ikke konkurrerer med den nukleofile addition af phenylhydrazin til carbonylgruppen i cyclohexanon. Som et resultat heraf kan dannelsen af den cykliske hydrazon (produkt A) være begunstiget i DMSO. Den intramolekylære ringslutningsreaktion for at danne den cykliske hydrazon er mere tilbøjelig til at forekomme i fravær af protiske opløsningsmidler som vand, som kan interferere med reaktionen ved at danne hydrogenbindinger med reaktanterne eller produkterne.
2. Reduceret dannelse af åbenkædet hydrazon (produkt B): Tilstedeværelsen af vand i reaktionsblandingen kan fremme dannelsen af åbenkædet hydrazon (produkt B) gennem protonoverførselsreaktioner. Vandmolekyler kan fungere som en protonkilde, hvilket letter protoneringen af nitrogenatomet i phenylhydrazin. Dette protonerede mellemprodukt kan derefter gennemgå nukleofil addition til carbonylgruppen, hvilket fører til dannelsen af den åbne kæde hydrazon. I et aprotisk opløsningsmiddel som DMSO ville fraværet af let tilgængelige protoner være ugunstigt for denne vej, hvilket resulterer i et fald i dannelsen af produkt B.
Sammenfattende kan anvendelse af et aprotisk opløsningsmiddel såsom DMSO i stedet for vand i reaktionen af cyclohexanon med phenylhydrazin føre til en øget dannelse af den cykliske hydrazon (produkt A) og en nedsat dannelse af den åbne hydrazon (produkt B). Ændringen i produktforhold skyldes de forskellige solvatiseringsegenskaber og fraværet af protiske hydrogenatomer i DMSO, som påvirker reaktionsvejene og ligevægten.
 Varme artikler
Varme artikler
-
 Spinout søger at omdanne test af fødevaresikkerhedJanus-emulsionsdråber fanges i færd med at ændre form som reaktion på tilstedeværelsen af forurening med et fødevarepatogen i et laboratoriemiljø. Emulsionerne kan ses med det blotte øje og, ved hjæ
Spinout søger at omdanne test af fødevaresikkerhedJanus-emulsionsdråber fanges i færd med at ændre form som reaktion på tilstedeværelsen af forurening med et fødevarepatogen i et laboratoriemiljø. Emulsionerne kan ses med det blotte øje og, ved hjæ -
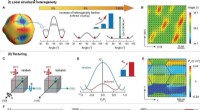 Ultrahøj piezoelektrisk ydeevne demonstreret i keramiske materialerFænomenologisk illustration og fasefeltsimulering af forbedret piezoelektricitet via lokal strukturel heterogenitet og teksturteknik. A) Landau fri energi af ferroelektriske stoffer med forskellig vol
Ultrahøj piezoelektrisk ydeevne demonstreret i keramiske materialerFænomenologisk illustration og fasefeltsimulering af forbedret piezoelektricitet via lokal strukturel heterogenitet og teksturteknik. A) Landau fri energi af ferroelektriske stoffer med forskellig vol -
 Første gangs direkte bevis på kemiske reaktioner i partiklerMed denne enhed, partikler kan analyseres bedre end nogensinde før. Kredit:Paul Scherrer Institute/Mahir Dzambegovic Forskere ved Paul Scherrer Institute PSI har udviklet en ny metode til at analy
Første gangs direkte bevis på kemiske reaktioner i partiklerMed denne enhed, partikler kan analyseres bedre end nogensinde før. Kredit:Paul Scherrer Institute/Mahir Dzambegovic Forskere ved Paul Scherrer Institute PSI har udviklet en ny metode til at analy -
 Forskere skræddersyr E. coli til at omdanne planter til vedvarende kemikalierSandia National Laboratories forskere Seema Singh, venstre; og Fang Liu holder hætteglas med vanillin og gæringsbouillon, som er afgørende for at omdanne plantemateriale til biobrændstoffer og andre v
Forskere skræddersyr E. coli til at omdanne planter til vedvarende kemikalierSandia National Laboratories forskere Seema Singh, venstre; og Fang Liu holder hætteglas med vanillin og gæringsbouillon, som er afgørende for at omdanne plantemateriale til biobrændstoffer og andre v
- Hundreder langs Cambridge -gader for at ære Stephen Hawking
- Aktivering af prodrug ved hjælp af proteinindkapslet guldkatalysator
- Grøn gødning fremstillet af komøg og kyllingefjer kunne forvandle store landbrug
- Der er et presserende behov for at demokratisere viden for at revolutionere globale fødevaresysteme…
- Med storme i maj, lovgiver ønsker en længere orkansæson
- Lav en vådcellebatteri


