Hvad er tætheden af fluorgas ved 7,00 x 102 torr og 27,0C Molær masse er lig med 38,0 gmol?
PV =nRT
hvor P er trykket, V er volumenet, n er antallet af mol, R er idealgaskonstanten, og T er temperaturen.
Vi kan omarrangere denne ligning for at løse densiteten, som er defineret som masse pr. volumenenhed:
massefylde =masse/volumen =(n * molær masse)/V
Først skal vi konvertere trykket fra torr til atmosfærer (atm):
7,00 x 10^2 torr * (1 atm / 760 torr) =0,921 atm
Dernæst skal vi konvertere temperaturen fra grader Celsius (°C) til Kelvin (K):
27,0 °C + 273,15 =300,15 K
Nu kan vi beregne antallet af mol fluorgas ved hjælp af den ideelle gaslov:
n =PV/RT =(0,921 atm * V) / (0,08206 L atm/mol K * 300,15 K)
Da vi ikke kender lydstyrken, lader vi det være V indtil videre.
Til sidst kan vi beregne tætheden:
massefylde =(n * molær masse)/V =[(0,921 atm * V) / (0,08206 L atm/mol K * 300,15 K)] * (38,0 g/mol) / V
Forenkling af udtrykket:
massefylde =(1,458 g/L) * (0,921 atm/V)
Derfor er tætheden af fluorgas ved 7,00 x 10^2 torr og 27,0 °C 1,458 g/L ganget med forholdet 0,921 atm til volumenet i liter.
 Varme artikler
Varme artikler
-
 Verdens første bioklodser dyrket fra menneskelig urinVerdens første bio-klods lavet af menneskelig urin blev afsløret på UCT i denne uge. På billedet er (fra venstre) Department of Civil Engineering Dr. Dyllon Randall og hans studerende, Vukheta Mukhari
Verdens første bioklodser dyrket fra menneskelig urinVerdens første bio-klods lavet af menneskelig urin blev afsløret på UCT i denne uge. På billedet er (fra venstre) Department of Civil Engineering Dr. Dyllon Randall og hans studerende, Vukheta Mukhari -
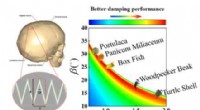 Forholdet mellem sart suturstruktur og dæmpning af biomaterialerFigur 1. De teoretiske modelforudsigelser tyder på, at suturstrukturer fundet i en række naturlige manifestationer har udviklet sig til deres optimale geometrier for at opnå den bedste dæmpningsydelse
Forholdet mellem sart suturstruktur og dæmpning af biomaterialerFigur 1. De teoretiske modelforudsigelser tyder på, at suturstrukturer fundet i en række naturlige manifestationer har udviklet sig til deres optimale geometrier for at opnå den bedste dæmpningsydelse -
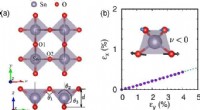 Forskere laver teoretisk forudsigelse af 2-D halvleder tindioxidFig. 1. (a) Atomstrukturen af et 2D δ-SnO2-monolag. (b) Stammen i x -retningen som følge af en påført trækbelastning i y -retningen. Kredit:JIANG Peng For nylig, Prof. 2 ) enkeltlagsfase (P-4
Forskere laver teoretisk forudsigelse af 2-D halvleder tindioxidFig. 1. (a) Atomstrukturen af et 2D δ-SnO2-monolag. (b) Stammen i x -retningen som følge af en påført trækbelastning i y -retningen. Kredit:JIANG Peng For nylig, Prof. 2 ) enkeltlagsfase (P-4 -
 Belysning af de molekylære mål for eicosapentaensyre:Et naturligt middel mod kronisk smerteNy undersøgelse identificerer vesikulær nukleotidtransportør som et nyt mål for eicosapentaensyre (EPA) og fremhæver den mekanisme, der ligger til grund for den analgetiske virkning af EPA. EPA dæmper
Belysning af de molekylære mål for eicosapentaensyre:Et naturligt middel mod kronisk smerteNy undersøgelse identificerer vesikulær nukleotidtransportør som et nyt mål for eicosapentaensyre (EPA) og fremhæver den mekanisme, der ligger til grund for den analgetiske virkning af EPA. EPA dæmper
- Undervurdering af kunstvandede afgrøder risikerer vandmangel
- Boykot eller buycott? Virksomhedsaktivismens rolle
- Ny separationsproces for nøgleradiodiagnostisk middel reducerer radioaktivt affald
- Ingen plads til en varmepumpe? Sådan kunne hele din gade slippe for gasopvarmning
- Rejs gennem data fra rummet i nye 3D Instagram-oplevelser
- Sentinel-1 advarer mod risiko for oversvømmelse af flygtningeøer


