Belysning af de molekylære mål for eicosapentaensyre:Et naturligt middel mod kronisk smerte
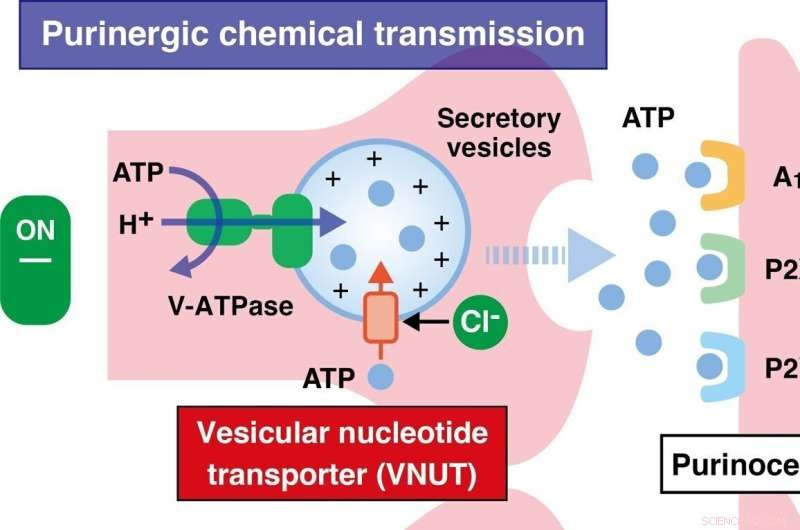
Ny undersøgelse identificerer vesikulær nukleotidtransportør som et nyt mål for eicosapentaensyre (EPA) og fremhæver den mekanisme, der ligger til grund for den analgetiske virkning af EPA. EPA dæmper kraftigt neuropatiske og inflammatoriske smerter og insulinresistens med færre bivirkninger. Kredit:Takaaki Miyaji fra Okayama University
Eicosapentaensyre (EPA) er et essentielt næringsstof, der tilhører omega-3-gruppen af flerumættede fedtsyrer (PUFA'er). Da den menneskelige krop ikke kan syntetisere PUFA'er, er kosttilskud, der indeholder EPA, nødvendige for normale fysiologiske funktioner. Findes rigeligt i naturlige kilder som fisk, hampolie og hørfrøolie, EPA er kendt for at udvise antiinflammatoriske, neurobeskyttende og kardiovaskulære beskyttende aktiviteter.
Derudover har nyere undersøgelser vist dets terapeutiske virkninger med hensyn til at reducere dødelighedsrisikoen efter myokardieinfarkt, forbedre insulinresistens, reducere blodlipidniveauer og hæmme blodpladeaggregation. Omega-3 PUFA'er har også vist sig at reducere inflammatoriske reaktioner efter COVID-19-infektion. På trods af det brede spektrum af dets terapeutiske virkninger forbliver det eller de molekylære mål og den underliggende mekanisme for EPA's virkning uhåndgribelige.
Forskningsprofessor Takaaki Miyaji fra Okayama University, Japan, og hans team af forskere har nu afsløret et nyt molekylært mål for EPA i deres seneste arbejde offentliggjort i tidsskriftet Proceedings of the National Academy of Sciences .
Forskningsprofessor Miyaji, den korresponderende forfatter til denne artikel, forklarer rationalet bag deres undersøgelse, at "konventionelle molekylære mål såsom COX-2-hæmmere kan forklare de antiinflammatoriske og smertestillende virkninger for inflammatorisk smerte, men ikke neuropatisk smerte, af EPA Men da EPA markant dæmper både inflammatorisk og neuropatisk smerte, er der en stærk mulighed for, at der eksisterer et andet vigtigt molekylært mål for EPA relateret til neuropati." Holdet dykkede dybere og søgte derfor at forstå virkningsmekanismen af EPA til at lindre både inflammatorisk og neuropatisk smerte.
Under neurologiske, metaboliske og immunologiske forstyrrelser fører "purinerg" kemisk transmission (en form for ekstracellulær signalering medieret af purinderivater) til binding af energibærere som adenosintrifosfat (ATP) til "purinoreceptorer", som inducerer og forværrer neuropatiske og inflammatorisk smerteopfattelse. Denne binding medieres af en vesikulær nukleotidtransporter (VNUT), som dermed bliver nøglemolekylet i initieringen af purinerg signalering. Forskerne antog, at EPA er rettet mod VNUT og derved blokerer purinerg kemisk transmission og reducerer smerteopfattelsen.
Forskningsprofessor Miyaji og hans team testede denne hypotese både in vitro ved hjælp af humant afledt VNUT og in vivo ved hjælp af en VNUT-defekt musemodel.
De fandt ud af, at EPA konkurrerer med klorioner, der normalt aktiverer VNUT og hæmmer VNUT-medieret frigivelse af ATP. Desuden observerede de denne effekt kun med EPA og dets metabolitter og ikke med docosahexaensyre, en anden omega-3 fedtsyre, hvilket tyder på, at strukturen af omega-3 fedtsyrer med sidekæder er nødvendig for VNUT-hæmning.
Yderligere inducerede de neuropatisk smerte hos vildtype- og VNUT-deficiente mus ved hjælp af kemoterapeutiske midler, der bruges i cancerbehandling. EPA fremhævede især smerte hos vildtypedyr, men ikke hos VNUT-mangelfulde mus, hvilket bekræfter deres tidligere fund om den hæmmende effekt af EPA på VNUT. Tilsvarende har insulinresistens induceret af neuropatisk smerte vist sig at blive reduceret ved EPA-behandling i vildtype, men ikke hos VNUT-mangelfulde mus.
"Vi fandt ud af, at lave koncentrationer af EPA fuldstændigt og reversibelt hæmmede frigivelsen af ATP fra neuroner uden at hæmme frigivelsen af andre neurotransmittere. Sammenlignet med andre lægemidler viste EPA en højere smertestillende effekt og færre bivirkninger," forklarer forskningsprofessor Miyaji.
Desuden kan neuropatisk smerte og tilhørende insulinresistens, de smertestillende virkninger af EPA udvides yderligere til kroniske smerter forbundet med flere andre tilstande som kemoterapi, diabetes, gigt, gigt, iskiasnerveligation og inflammation. Derudover er purinerg kemisk transmission også forbundet med en række tilstande, herunder Alzheimers sygdom og depression, for hvilke EPA kan udforskes som en terapeutisk strategi.
Desuden kan opioider og andre smertestillende medicin have langsigtede bivirkninger og resultere i afhængighed. I mangel af optimale lægemiddelbehandlinger med færre bivirkninger, fører kroniske smerter til en nedsat livskvalitet, udover at øge den økonomiske byrde ved behandlingen. Med denne opdagelse kan 'næringsstofbaseret EPA' og dets metabolitter indikeres i behandlingen af kroniske smerter, samtidig med at potentielle bivirkninger holdes i skak.
Forskningsprofessor Miyaji uddyber de langsigtede implikationer af deres forskning og tilføjer, at deres "resultater kan hjælpe med at udvikle nye næringsstofbaserede behandlings- og forebyggelsesstrategier ved at målrette purinergisk kemisk transmission for inflammatoriske, neurologiske og metaboliske sygdomme uden de negative bivirkninger af konventionel smertestillende medicin." + Udforsk yderligere
Potentielt lægemiddel til behandling af kroniske smerter med få bivirkninger
 Varme artikler
Varme artikler
-
 I formhukommelseslegeringer, den rigtige kombination af krystalkorn kan opnå høj styrke og stadig …Simuleret formhukommelsesfaseovergang i en formhukommelseslegering med små og store krystalkorn. Kredit:IOP Publishing A*STAR forskere har vist, gennem en supercomputersimulering, at høj styrke og
I formhukommelseslegeringer, den rigtige kombination af krystalkorn kan opnå høj styrke og stadig …Simuleret formhukommelsesfaseovergang i en formhukommelseslegering med små og store krystalkorn. Kredit:IOP Publishing A*STAR forskere har vist, gennem en supercomputersimulering, at høj styrke og -
 Omdanner kuldioxid til metan eller etan selektivt(a) Prøvebilleder opnået på forskellige stadier af syntese (b) Kumulativ metan- og etanudvikling for forskellige Pt vægtprocent sensibiliserede 0,50-G/RBT-prøver. Kredit:Daegu Gyeongbuk Institute of S
Omdanner kuldioxid til metan eller etan selektivt(a) Prøvebilleder opnået på forskellige stadier af syntese (b) Kumulativ metan- og etanudvikling for forskellige Pt vægtprocent sensibiliserede 0,50-G/RBT-prøver. Kredit:Daegu Gyeongbuk Institute of S -
 Udtrække information fra gamle tænderKredit:CC0 Public Domain Der er en overraskende mængde information gemt i den hærdede plak, eller beregning, mellem tænderne. Og hvis den beregning tilhører resterne af en person, der levede i old
Udtrække information fra gamle tænderKredit:CC0 Public Domain Der er en overraskende mængde information gemt i den hærdede plak, eller beregning, mellem tænderne. Og hvis den beregning tilhører resterne af en person, der levede i old -
 Clingy kobberioner bidrager til katalysatorafmatningKredit: ACS -katalyse Kraftige dieseltrucks på vejen i dag er udstyret med efterbehandlingssystemer, der inkluderer selektiv katalytisk reduktion (SCR) teknologi, der anvender urinstofopløsning s
Clingy kobberioner bidrager til katalysatorafmatningKredit: ACS -katalyse Kraftige dieseltrucks på vejen i dag er udstyret med efterbehandlingssystemer, der inkluderer selektiv katalytisk reduktion (SCR) teknologi, der anvender urinstofopløsning s
- Roverfund giver et glimt af Red Planets oldtidslandskab
- Sådan beregnes termisk udvidelse af en cylinder
- Stigende havtemperaturer truer strandengene og deres evne til at holde kulstof
- Sådan løses sammensatte uligheder
- Hvad anvendes termoelementer til?
- Amazoniske afgrøder domesticeret 10, 000 år siden


