Hvad med en syre og en base bestemmes af, hvor fuldstændigt de dissocierer i vand?
Når en syre opløses i vand, donerer den en hydrogenion (H+) til vandmolekylet. Jo flere brintioner en syre donerer, jo højere er surhedsgraden. Omvendt, når en base opløses i vand, accepterer den en hydrogenion fra vandmolekylet. Jo flere hydrogenioner en base accepterer, jo højere er dens basicitet.
Styrken af en syre eller base kan måles ved hjælp af en pH-skala. pH-skalaen går fra 0 til 14, hvor 7 er neutral. En pH under 7 indikerer en sur opløsning, mens en pH over 7 indikerer en basisk opløsning.
Følgende er nogle eksempler på stærke syrer og baser:
Stærke syrer :
- Saltsyre (HCl)
- Svovlsyre (H2SO4)
- Salpetersyre (HNO3)
Stærke baser :
- Natriumhydroxid (NaOH)
- Kaliumhydroxid (KOH)
- Calciumhydroxid (Ca(OH)2)
Svage syrer og baser er dem, der ikke dissocierer fuldstændigt i vand. Nogle eksempler på svage syrer og baser omfatter:
Svage syrer :
- Eddikesyre (CH3COOH)
- Kulsyre (H2CO3)
- Flussyre (HF)
Svage baser :
- Ammoniak (NH3)
- Natriumbicarbonat (NaHCO3)
- Calciumcarbonat (CaCO3)
 Varme artikler
Varme artikler
-
 Forskere programmerer biomaterialer med logiske porte, der frigiver terapeutika som reaktion på mil…Repræsentation af en simpel JA port. De grå og orange søjler repræsenterer hele porten, som forbinder til polymererne, der holder hydrogel sammen (sorte og lilla bølgede linjer). Porten åbnes - frigiv
Forskere programmerer biomaterialer med logiske porte, der frigiver terapeutika som reaktion på mil…Repræsentation af en simpel JA port. De grå og orange søjler repræsenterer hele porten, som forbinder til polymererne, der holder hydrogel sammen (sorte og lilla bølgede linjer). Porten åbnes - frigiv -
 Evergreen idé gør biomasse-DNA til nedbrydelige materialerKredit:CC0 Public Domain DNA har mange praktiske anvendelser. Det gemmer blueprintet af genetisk kode. Det hjælper med at indlede arternes udvikling. Det kan også potentielt gøre en stærkere, mer
Evergreen idé gør biomasse-DNA til nedbrydelige materialerKredit:CC0 Public Domain DNA har mange praktiske anvendelser. Det gemmer blueprintet af genetisk kode. Det hjælper med at indlede arternes udvikling. Det kan også potentielt gøre en stærkere, mer -
 Udskiftning af funktionelle grupper med en guldelektrode for at kontrollere et molekyles reaktivitetIBS- og KAIST-forskere brugte guldelektroden og fastgjorde målmolekylerne på elektroden. Ligesom funktionelle grupper genererer forskellige elektroniske effekter, en elektrode passer til alle reaktion
Udskiftning af funktionelle grupper med en guldelektrode for at kontrollere et molekyles reaktivitetIBS- og KAIST-forskere brugte guldelektroden og fastgjorde målmolekylerne på elektroden. Ligesom funktionelle grupper genererer forskellige elektroniske effekter, en elektrode passer til alle reaktion -
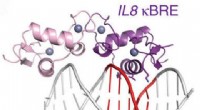 Duel af de inflammatoriske masterregulatorer – indsigt til lægemiddelopdagelseFigur:Diagram over glukokortikoidreceptoren, der binder et NF-kappaB-sted. Kredit:Hudson et al. Naturkommunikation (2018). Anti-inflammatoriske lægemidler såsom dexamethason kan have skadelige biv
Duel af de inflammatoriske masterregulatorer – indsigt til lægemiddelopdagelseFigur:Diagram over glukokortikoidreceptoren, der binder et NF-kappaB-sted. Kredit:Hudson et al. Naturkommunikation (2018). Anti-inflammatoriske lægemidler såsom dexamethason kan have skadelige biv
- Hvad er antonymet for opløst stof i videnskaben?
- Hvordan regnbuer virker
- I nyt kvantecomputerdesign bruger qubits magneter til selektivt at kommunikere
- Nyt værktøj afslører de virkelige drivhusgasaftryk af reservoirer
- Forskere laver komplekst molekyle, der spontant folder som et protein
- Forskere rapporterer verdens første fibrøse aggregat af carbon nanohorns


