Hvordan fastholder kemiske bindinger elementer?
Kovalente bindinger opstår, når to eller flere atomer deler et eller flere elektronpar. Denne type binding er den stærkeste og findes i molekyler som vand (H2O) og metan (CH4).
Ionbindinger opstår, når et atom overfører en eller flere elektroner til et andet atom. Denne type binding findes i forbindelser som natriumchlorid (NaCl) og kaliumiodid (KI).
Metalbindinger opstår, når atomerne i et metal deler et hav af elektroner. Denne type binding findes i metaller som kobber, aluminium og jern.
Styrken af en kemisk binding bestemmes af elektronegativiteten af de involverede atomer. Elektronegativitet er et mål for et atoms evne til at tiltrække elektroner. Jo større forskellen er i elektronegativitet mellem to atomer, jo stærkere vil bindingen være.
Kemiske bindinger er afgørende for at holde grundstoffer sammen og danne forbindelser. De bestemmer også egenskaberne af forbindelser, såsom deres smeltepunkt, kogepunkt og opløselighed.
Sidste artikelHvad er de ikke-Hvilke af disse er ikke en type kemisk binding?
Næste artikelHvilken type binding er C7H6O3?
 Varme artikler
Varme artikler
-
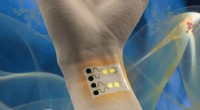 En bærbar gassensor til sundheds- og miljøovervågningEn bærbar gassensor kan overvåge miljømæssige og medicinske forhold. Kredit:Cheng Lab/Penn State En meget følsom, Bærbar gassensor til miljø- og sundhedsovervågning kan snart blive kommercielt til
En bærbar gassensor til sundheds- og miljøovervågningEn bærbar gassensor kan overvåge miljømæssige og medicinske forhold. Kredit:Cheng Lab/Penn State En meget følsom, Bærbar gassensor til miljø- og sundhedsovervågning kan snart blive kommercielt til -
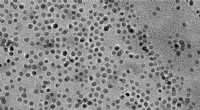 Formindskelse af et kemikalies kulstofaftryk i hverdagsgenstandeMIT-forskere brugte disse manganoxid-nanopartikler til at katalysere nedbrydningen af vand og den efterfølgende inkorporering af ilt i nyttige forbindelser kaldet epoxider. Kredit:researchers/MIT
Formindskelse af et kemikalies kulstofaftryk i hverdagsgenstandeMIT-forskere brugte disse manganoxid-nanopartikler til at katalysere nedbrydningen af vand og den efterfølgende inkorporering af ilt i nyttige forbindelser kaldet epoxider. Kredit:researchers/MIT -
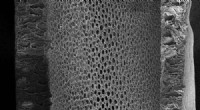 Membraner til industriel separering af kemiske blandingerEn overlegen membran, med en højere poretæthed, fremstilles ved syntetisering af denne polyacrylonitril -nanofiltreringsmembran ved hjælp af et ionisk flydende opløsningsmiddel. Kredit:© 2017 Susana N
Membraner til industriel separering af kemiske blandingerEn overlegen membran, med en højere poretæthed, fremstilles ved syntetisering af denne polyacrylonitril -nanofiltreringsmembran ved hjælp af et ionisk flydende opløsningsmiddel. Kredit:© 2017 Susana N -
 Cheminformatics tilgange til at skabe nye hårfarverForskere bruger Max Weaver Dye Library til at finde nye, sikrere hårfarveprodukter. Kredit:George Van Den Driessche. At finde den næste generation af sikrere hårfarver kan være lige så simpelt som
Cheminformatics tilgange til at skabe nye hårfarverForskere bruger Max Weaver Dye Library til at finde nye, sikrere hårfarveprodukter. Kredit:George Van Den Driessche. At finde den næste generation af sikrere hårfarver kan være lige så simpelt som


