Hvad er de ikke-Hvilke af disse er ikke en type kemisk binding?
En kemisk binding er en varig tiltrækning mellem atomer, ioner eller molekyler, der muliggør dannelsen af kemiske forbindelser. Typen af kemisk binding afhænger af forskellen i elektronegativitet af de involverede atomer og den elektroniske struktur af molekylet som helhed.
Der er tre hovedtyper af kemiske bindinger:ioniske, kovalente og metalliske.
- ioniske bindinger dannes, når en eller flere elektroner overføres fra et atom til et andet, hvilket skaber modsat ladede ioner. Tiltrækningen mellem disse ioner holder forbindelsen sammen.
- Kovalente bindinger dannes, når to eller flere atomer deler et eller flere elektronpar. De delte elektroner holdes i et område med høj elektrontæthed mellem atomernes kerner.
- Metalbindinger dannes, når de yderste elektroner af metalatomer delokaliseres, hvilket betyder, at de ikke er forbundet med et atom, men i stedet bevæger sig frit gennem hele metalgitteret.
Hydrogenbindinger er en type intermolekylær kraft, ikke en kemisk binding. De dannes, når et brintatom kovalent bundet til et meget elektronegativt atom (såsom nitrogen, oxygen eller fluor) interagerer med et andet elektronegativt atom. Denne interaktion skaber en dipol-dipol attraktion, der holder de to molekyler sammen.
Så svaret er hydrogenbindinger.
 Varme artikler
Varme artikler
-
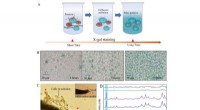 Ny SERS-strategi udviklet til beta-galactosidase aktivitetsanalyseIn-situ SERS udlæsningsstrategi for individuelle celler. (A) Skematisk strategi for at forbedre pålideligheden ved at forkorte farvningstider. (B) X-gal farvning assay for celler. (C og D) In-situ SER
Ny SERS-strategi udviklet til beta-galactosidase aktivitetsanalyseIn-situ SERS udlæsningsstrategi for individuelle celler. (A) Skematisk strategi for at forbedre pålideligheden ved at forkorte farvningstider. (B) X-gal farvning assay for celler. (C og D) In-situ SER -
 Kan du lave en 10-årig maltwhisky på uger? Kemien siger jaVille du stadig være villig til at vente på whisky? Kredit:Shutterstock.com I løbet af de sidste par år er whisky-drikkende verden blevet introduceret til adskillige nye produkter, der hævder at p
Kan du lave en 10-årig maltwhisky på uger? Kemien siger jaVille du stadig være villig til at vente på whisky? Kredit:Shutterstock.com I løbet af de sidste par år er whisky-drikkende verden blevet introduceret til adskillige nye produkter, der hævder at p -
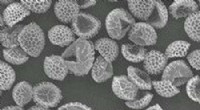 Rengøring af forurenende stoffer fra vand med pollen og sporer - uden achoo!De fyldte overflader af behandlede sporkorn, her vist forstørret cirka 300 gange, kan fjerne uønskede kemikalier fra forurenet vand. Kredit:Andrew Boa og Aimilia Meichanetzoglou Ud over deres roll
Rengøring af forurenende stoffer fra vand med pollen og sporer - uden achoo!De fyldte overflader af behandlede sporkorn, her vist forstørret cirka 300 gange, kan fjerne uønskede kemikalier fra forurenet vand. Kredit:Andrew Boa og Aimilia Meichanetzoglou Ud over deres roll -
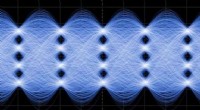 Forskere udvikler ultrahurtige polymermodulatorer, der kan tage varmenBølgeformer af data transmitteret med 200 Gbit/s ved hjælp af en hybrid-polymer modulator, der er i stand til at fungere ved temperaturer op til 110 °C. Signalerne kan tage et af fire forskellige nive
Forskere udvikler ultrahurtige polymermodulatorer, der kan tage varmenBølgeformer af data transmitteret med 200 Gbit/s ved hjælp af en hybrid-polymer modulator, der er i stand til at fungere ved temperaturer op til 110 °C. Signalerne kan tage et af fire forskellige nive
- Undersøgelse afslører ansættelsesbias mod tidligere virksomhedsejere
- Laboratorieforsøg tyder på, at vand var i måneblanding under dets dannelse
- Forskere afslører, hvordan celler ødelægger RNA, en nøgle til at forstå sygdom
- Nye kontorer gør os mere imagebevidste
- Hvad er ESP? Sådan fungerer ESP
- Sådan finder du omkredsen af en halvcirkel


