Hvor mange molekyler er indeholdt i en prøve på 5,20 g dimethylkviksølv?
Den molære masse af dimethylkviksølv (CH3)2Hg er:
2(12,01 g/mol) + 12 x 1,008 g/mol + 200,59 g/mol =230,66 g/mol
Antallet af mol i en 5,20 g prøve af dimethylkviksølv er:
$$5,20 \text{ g} \times \frac{1 \text{ mol}}{230,66 \text{ g}} =0,02257 \text{ mol}$$
Antallet af molekyler i en 5,20 g prøve af dimethylkviksølv er:
$$0,02257 \text{ mol} \times 6,022 \times 10^{23} \text{ molecules/mol} =1,357 \times 10^{23} \text{ molecules}$$
Derfor er der 1,357 x 10^23 molekyler indeholdt i en 5,20-g prøve af dimethylkviksølv.
 Varme artikler
Varme artikler
-
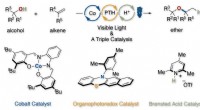 Udvikling af en ny metode til syntetisering af dialkylethere ved hjælp af tre katalysatorer, der hy…Præcis kontrol af protoner og elektroner ved fotoredox/cobalt/Brønsted syrekatalyse giver værdifulde dialkylethere fra let tilgængelige alkoholer og alkener uden stærke syrer. Kredit:KyotoU/Hirohisa O
Udvikling af en ny metode til syntetisering af dialkylethere ved hjælp af tre katalysatorer, der hy…Præcis kontrol af protoner og elektroner ved fotoredox/cobalt/Brønsted syrekatalyse giver værdifulde dialkylethere fra let tilgængelige alkoholer og alkener uden stærke syrer. Kredit:KyotoU/Hirohisa O -
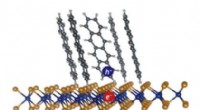 Hurtigt bevægende elektroner skaber strøm i organiske solcellerEn exciton (elektron-hul-par) dannet ved grænsefladen mellem tetracen-molekyler (en organisk halvleder) og enkeltlags WS2 (en uorganisk halvleder). Dissociation af sådanne grænseflade excitoner er nød
Hurtigt bevægende elektroner skaber strøm i organiske solcellerEn exciton (elektron-hul-par) dannet ved grænsefladen mellem tetracen-molekyler (en organisk halvleder) og enkeltlags WS2 (en uorganisk halvleder). Dissociation af sådanne grænseflade excitoner er nød -
 Meteoritnedslag kan skabe uventede former for silicaRøntgendiffraktionsbilleder, der viser den nye form for silica skabt ved at sende en intens stødbølge gennem en prøve af kvarts ved hjælp af en specialiseret gaspistol. Når røntgenstrålerne preller af
Meteoritnedslag kan skabe uventede former for silicaRøntgendiffraktionsbilleder, der viser den nye form for silica skabt ved at sende en intens stødbølge gennem en prøve af kvarts ved hjælp af en specialiseret gaspistol. Når røntgenstrålerne preller af -
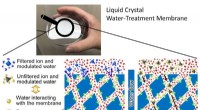 Meget selektive membraner:Forskere opdager, hvordan vand kan påvirke sin egen filtreringDen subnanoporøse væske-krystallinske vandbehandlingsmembran kan være meget selektiv med hensyn til, hvad den lader passere igennem. Kredit:Kato og Harada et al. Membraner med mikroskopiske porer
Meget selektive membraner:Forskere opdager, hvordan vand kan påvirke sin egen filtreringDen subnanoporøse væske-krystallinske vandbehandlingsmembran kan være meget selektiv med hensyn til, hvad den lader passere igennem. Kredit:Kato og Harada et al. Membraner med mikroskopiske porer
- Hvis din bærbare computer eller telefon bliver ved med at gå i stykker,
- Magnetiske pindsvin kunne lagre store data på et lille rum
- Landsbyboere følger geologien til mere sikkert vand i Bangladesh
- Kæledyr? Selskabsdyr? Etikere siger, at udtrykket betyder noget
- Lærer:Dumping af fossile brændstoffer inden 2050 er nødvendig for at spare klima
- Bedre luftkvalitet er forbundet med reducerede selvmordsrater, viser undersøgelsen


