Hvordan vil radium reagere med ilt?
2Ra + O2 → 2RaO
I denne reaktion mister radiumatomer to valenselektroner til oxygenatomer, hvilket resulterer i dannelsen af positivt ladede radiumioner (Ra2+) og negativt ladede oxidioner (O2-). Den elektrostatiske tiltrækning mellem radium- og oxidionerne fører til dannelsen af en stabil ionisk forbindelse, radiumoxid.
Radiums reaktion med ilt er meget eksoterm og frigiver en betydelig mængde varme og lys. Dette gør radium til et ekstremt farligt element at håndtere, da det let kan antændes og forårsage brande eller eksplosioner. Radium reagerer også kraftigt med vand for at danne radiumhydroxid og brintgas.
På grund af dets høje reaktivitet og de tilhørende sikkerhedsrisici håndteres og opbevares radium med ekstrem forsigtighed i specialiserede faciliteter. Det bruges primært i små mængder til medicinske formål, såsom strålebehandling, og i visse industrielle anvendelser, såsom radiografi og ioniseringskilder.
Sidste artikelHvad sker der, hvis calcium og syre blandes?
Næste artikelHvad er sammensætningen af bærbart toiletkemikalie?
 Varme artikler
Varme artikler
-
 Forskning viser, at det er varmt at gøre twist, at slappe af er fedtDenne naturgummifiber er blevet belagt med en maling, der skifter farve, når fiberen ændrer temperatur. University of Texas i Dallas forskere og deres kolleger i Kina viste for nylig, at når gummifibe
Forskning viser, at det er varmt at gøre twist, at slappe af er fedtDenne naturgummifiber er blevet belagt med en maling, der skifter farve, når fiberen ændrer temperatur. University of Texas i Dallas forskere og deres kolleger i Kina viste for nylig, at når gummifibe -
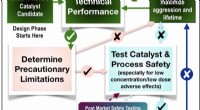 Rengøring af vores vand med banebrydende bioinspireret kemiDen udviklede designprotokol, der leverede den rekordholdige tekniske ydeevne peroxidase, der efterligner NewTAML-katalysator. Protokollen bestræber sig på at integrere velafbalanceret og positiv tekn
Rengøring af vores vand med banebrydende bioinspireret kemiDen udviklede designprotokol, der leverede den rekordholdige tekniske ydeevne peroxidase, der efterligner NewTAML-katalysator. Protokollen bestræber sig på at integrere velafbalanceret og positiv tekn -
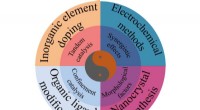 Tuningstrategier og struktureffekter af elektrokatalysatorer til kuldioxidreduktionsreaktionenForskellige afstemningsstrategier muliggør forskelle i katalysatorstrukturer. Hvordan træffer man et valg fra disse tilgængelige tuning-strategier? Der kan foretages en afvejning mellem den ønskede st
Tuningstrategier og struktureffekter af elektrokatalysatorer til kuldioxidreduktionsreaktionenForskellige afstemningsstrategier muliggør forskelle i katalysatorstrukturer. Hvordan træffer man et valg fra disse tilgængelige tuning-strategier? Der kan foretages en afvejning mellem den ønskede st -
 Infrarød sensor fungerer som et nyt værktøj til opdagelse af lægemidlerKredit:Sisacom, Shutterstock Forskere har fundet en ny metode til at analysere, hvordan aktive midler påvirker et specifikt protein, der er vigtigt for celleoverlevelse. Deres forskning kan hjælpe
Infrarød sensor fungerer som et nyt værktøj til opdagelse af lægemidlerKredit:Sisacom, Shutterstock Forskere har fundet en ny metode til at analysere, hvordan aktive midler påvirker et specifikt protein, der er vigtigt for celleoverlevelse. Deres forskning kan hjælpe
- Arbejdende elektroniske kredsløb produceret gennem kunstig evolution
- Forskere kortlægger de dybeste dele af det sydlige Ocean
- Nøgne forhistoriske monstre:Bevis på, at forhistoriske flyvende krybdyr sandsynligvis har fået fj…
- At sende overskydende mad til velgørende formål er ikke en måde at reducere drivhusgasemissioner …
- Hvilket grundstof nedsætter sit oxidationstal i følgende reaktion?
- Kemikalier anvendt i guldplating


