Hvad er forskellen mellem reaktive og ikke-metaller?
Reaktivitet:
Reaktive metaller er meget reaktive, hvilket betyder, at de let deltager i kemiske reaktioner. Ikke-reaktive metaller, også kendt som ædelmetaller, er mindre reaktive og har en tendens til at være mere stabile i deres rene form.
Korrosion:
Reaktive metaller er tilbøjelige til korrosion på grund af deres høje reaktivitet. De reagerer let med ilt, vand eller andre stoffer i deres omgivelser og danner oxider eller andre forbindelser. Ikke-reaktive metaller er på den anden side modstandsdygtige over for korrosion og danner ikke let sådanne forbindelser.
Lyster:
Reaktive metaller har typisk et skinnende, skinnende udseende på grund af deres evne til at reflektere lys. Ikke-reaktive metaller har også et skinnende udseende, men deres glans har en tendens til at være mere holdbar, da de er mindre modtagelige for pletter og korrosion.
Hårdhed:
Reaktive metaller er generelt blødere sammenlignet med ikke-reaktive metaller. Deres krystalstrukturer har en tendens til at være mindre tæt pakket, hvilket gør dem lettere at deformere eller skære. Ikke-reaktive metaller er på den anden side ofte hårdere, fordi de har mere tætpakkede krystalstrukturer.
Konduktivitet:
Reaktive metaller er generelt gode ledere af elektricitet og varme. De løst bundne valenselektroner i reaktive metaller muliggør lettere bevægelse af elektroner, hvilket letter effektiv energioverførsel. Ikke-reaktive metaller er også gode ledere, men de kan have lidt lavere ledningsevne på grund af deres stærkere bindinger.
Elektronkonfigurationer:
Reaktive metaller har ufuldstændige ydre elektronskaller, hvilket gør dem ivrige efter at miste elektroner og opnå stabilitet. Denne elektronkonfiguration driver deres høje reaktivitet. Ikke-reaktive metaller har derimod komplette ydre elektronskaller, hvilket gør dem mindre tilbøjelige til at miste eller få elektroner, deraf deres lavere reaktivitet.
Eksempler:
Reaktive metaller omfatter natrium (Na), kalium (K), calcium (Ca), jern (Fe) og aluminium (Al). Eksempler på ikke-reaktive metaller omfatter guld (Au), sølv (Ag), platin (Pt) og iridium (Ir).
Sammenfattende er reaktive metaller meget reaktive, tilbøjelige til korrosion, har et skinnende udseende, er relativt blødere og er gode ledere af elektricitet og varme. Ikke-reaktive metaller er på den anden side mindre reaktive, korrosionsbestandige, skinnende, hårdere og også gode ledere af elektricitet og varme.
Sidste artikelHvordan laver man boraxpulver til flydende borax?
Næste artikelHvad er nogle ikke-reaktive metaller?
 Varme artikler
Varme artikler
-
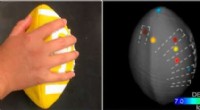 Robotics tager massespecifikationer til den tredje dimension for retsmedicin, farma applikationerVed at kombinere en robotarm og massespektrometri, forskere kan analysere overfladen af 3D-objekter, såsom fodbolde. Kredit:American Chemical Society Inden for det seneste årti, der er gjort man
Robotics tager massespecifikationer til den tredje dimension for retsmedicin, farma applikationerVed at kombinere en robotarm og massespektrometri, forskere kan analysere overfladen af 3D-objekter, såsom fodbolde. Kredit:American Chemical Society Inden for det seneste årti, der er gjort man -
 Ingeniører rapporterer om en ny metode til at producere nye fleksible LCD-skærmeOpdagelsen af RUDN-ingeniører vil hjælpe med at gøre fleksible og skabe 3D-billeder. Kredit:Allen Dressen RUDN-ingeniører har opdaget stoffer til at forenkle produktionen af fleksible LCD-skær
Ingeniører rapporterer om en ny metode til at producere nye fleksible LCD-skærmeOpdagelsen af RUDN-ingeniører vil hjælpe med at gøre fleksible og skabe 3D-billeder. Kredit:Allen Dressen RUDN-ingeniører har opdaget stoffer til at forenkle produktionen af fleksible LCD-skær -
 Lab afslører hjerte-på-en-chipGennem hjerte-på-en-chip-teknologi - modellering af et menneskeligt hjerte på en konstrueret chip og måling af virkningerne af forbindelseseksponering ved hjælp af mikroelektroder - håber Lawrence Liv
Lab afslører hjerte-på-en-chipGennem hjerte-på-en-chip-teknologi - modellering af et menneskeligt hjerte på en konstrueret chip og måling af virkningerne af forbindelseseksponering ved hjælp af mikroelektroder - håber Lawrence Liv -
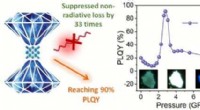 Opnå 90% PL-kvanteudbytte i 1-D metalhalogenid ved trykundertrykt ikke-strålende tabKredit:Center for High Pressure Science &Technology Advanced Research Lavdimensionelle perovskit-relaterede metalhalogenider er opstået som en ny klasse af lysemitterende materialer med afstemt br
Opnå 90% PL-kvanteudbytte i 1-D metalhalogenid ved trykundertrykt ikke-strålende tabKredit:Center for High Pressure Science &Technology Advanced Research Lavdimensionelle perovskit-relaterede metalhalogenider er opstået som en ny klasse af lysemitterende materialer med afstemt br
- Meget brugt kemikalie forbundet med 100, 000 amerikanske dødsfald om året:undersøgelse
- Teknologi, der bruger mikrobølgeopvarmning, kan påvirke fremstilling af elektronik
- Nyt spejl reflekterer lys anderledes end konventionelle spejle
- NASAs SDO ser en solplet vende sig mod Jorden
- Liste over ingredienser i Perricone MD Cold Plasma
- Volkswagens overskydende emissioner vil føre til 1, 200 for tidlige dødsfald i Europa, undersøgel…


